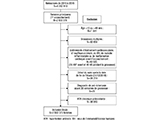
Impact des désordres hypertensifs de la grossesse sur la survenue d’une hypertension artérielle
// Impact of hypertensive disorders of pregnancy on the onset of chronic hypertension
Résumé
Objectif –
Les désordres hypertensifs de la grossesse (DHG) sont une cause majeure de morbi-mortalité materno-fœtale. L’objectif de l’étude était d’estimer l’impact des DHG sur la survenue d’une hypertension artérielle chronique chez les femmes, dans les premières années suivant l’accouchement.
Matériels et méthode –
Cette étude de cohorte nationale était basée sur les données du Système national des données de santé (SNDS). Nous avons inclus toutes les femmes primipares sans hypertension artérielle (HTA) chronique dans l’année précédant la grossesse, ayant accouché en France entre 2010 et 2018. Ces femmes ont été suivies en moyenne 3,0 années à partir de la 6e semaine post-partum. Durant le suivi, la survenue d’une HTA chronique était identifiée par au moins trois délivrances d’un traitement antihypertenseur. L’association entre les DHG et la survenue d’une HTA était évaluée grâce à des modèles de Cox, bruts et ajustés.
Résultats –
Au total, 2 663 573 femmes ont été incluses avec un suivi moyen de 3,0 ans. Parmi elles, 180 063 (6,73%) ont développé un DHG, dont 57 595 (2,13%) de pré-éclampsie (PE) et 113 803 (4,27%) d’hypertension gravidique (HG). Les Hazard Ratios de développer une hypertension artérielle, en comparaison des femmes sans DHG, étaient de 6,03 (IC95%: [5,89-6,17]) pour l’HG, 8,10 [7,88-8,33] pour la PE, 12,95 [12,29-13,65] pour la PE précoce, 9,90 [9,53-10,28] pour la PE sévère et 13,17 [12,74-13,60] pour la PE associée à une HG. La durée d’exposition était associée à un sur-risque d’HTA pour la PE, mais pas pour l’HG.
Conclusion –
Les DHG augmentent fortement le risque de développer une hypertension dans les années suivant l’accouchement.
Abstract
Aims –
Hypertensive disorders of pregnancy (HDP) are a leading cause of maternal and foetal morbidity and mortality. We aimed to estimate the impact of HDP on the onset of chronic hypertension in primiparous women in the first years following childbirth.
Material and methods –
This nationwide cohort study used data from the French National Health Data System (SNDS). All eligible primiparous women without pre-existing chronic hypertension who delivered between 2010 and 2018 were included. Women were followed from six weeks post-partum until onset of hypertension, a cardiovascular event, death or the study end-date (31 December 2018). During the follow-up, onset of chronic hypertension was recognised by at least three prescriptions of antihypertensive treatment. We used Cox models to estimate hazard ratios of chronic hypertension for all types of HDP.
Results –
Overall, 2,663,573 women were included with a mean follow-up time of 3.0 years. Among them, 180,063 (6.73%) had an HDP. Specifically 57,595 (2.16%) had preeclampsia (PE) and 113,803 (4.27%) had gestational hypertension (GH). Compared with women who had no HDP, the fully-adjusted hazard ratios (HRs) of chronic hypertension were 6.03 (95% CI: [5.89-6.17]) for GH, 8.10 [7.88-8.33] for PE (all sorts), 12.95 [12.29-13.65]
for early PE, 9.90 [9.53-10.28] for severe PE and 12.49 [11.76-13.27] for PE following GH. HDP exposure duration was an additional risk factor of chronic hypertension for all PE subgroups. Women with HDP consulted a general practitioner or cardiologist more frequently and earlier.
Conclusion –
HDP exposure greatly increased the risk of chronic hypertension in the first years following delivery.
Introduction
Au cours d’une grossesse normale, le niveau de pression artérielle diminue en début de grossesse, puis augmente de nouveau progressivement jusqu’à l’accouchement pour rejoindre approximativement le niveau tensionnel d’avant la grossesse 1. Cette baisse tensionnelle en début de grossesse est principalement en rapport avec des modifications de volume extracellulaire, des modifications hémodynamiques ainsi que des modifications de la fonction rénale. Parfois ces adaptations font défaut et l’on peut observer des désordres hypertensifs pendant la grossesse (DHG). Ces désordres hypertensifs, qui comprennent principalement l’hypertension gravidique (HG), la pré-éclampsie (PE) et l’éclampsie, représentent une des causes principales de morbi-mortalité maternelle et fœtale et une cause importante de prématurité chez l’enfant, notamment dans les pays en développement 2,3,4. On estime que les DHG concernent entre 5 et 10% des grossesses dans le monde 5. Récemment, une étude populationnelle basée sur les données du Système national des données de santé (SNDS) a estimé que la prévalence des DHG en France était de 7,4% (9,1% et 6,3% chez les primipares et les multipares, respectivement) 6. En raison de l’augmentation de l’âge de la première grossesse et de l’augmentation de la prévalence de la surcharge pondérale et de l’obésité notamment, la prévalence des DHG est en augmentation dans plusieurs pays ces dernières décennies 7.
Après l’accouchement, malgré un retour fréquent au niveau tensionnel initial chez les femmes ayant eu un DHG, le risque à long terme de développer une HTA chronique, une maladie cardiovasculaire ou rénale précoce est augmenté 8,9,10,11,12,13,14,15. Cependant, l’impact à court terme des DHG sur la survenue de ces événements et notamment l’HTA chronique reste insuffisamment étudié. Dans ce contexte, l’objectif de l’étude était d’estimer l’impact des différents types de DHG et de leur durée sur la survenue d’une HTA chronique dans les premières années suivant un premier accouchement, et de décrire le suivi médical des femmes ayant eu un DHG.
Matériels et méthode
Base de données
L’étude Conception est une étude de cohorte française conçue pour étudier l’épidémiologie des DHG et des événements cardiovasculaires parmi les femmes ayant accouché en France, entre 2010 et 2018, à partir des données du SNDS 16. Celui-ci comporte une information exhaustive sur tous les remboursements de soins réalisés par l’Assurance maladie, pour la quasi-totalité de la population française. Il comprend le Programme de médicalisation des systèmes d'information (PMSI), qui comporte les données d’hospitalisations publiques et privées, y compris les diagnostics codés avec la 10e révision de la Classification internationale des maladies (CIM-10), et la base de Données de consommation inter-régimes (DCIR) qui comprend les données relatives aux remboursements de prestations de soins de ville (médicaments, consultations, examens etc.). La méthodologie et la description de cette cohorte ont été publiées précédemment 6,17.
Population d’étude
Nous avons inclus dans l'analyse toutes les femmes primipares de la cohorte Conception ayant accouché entre le 1er janvier 2010 et le 31 décembre 2018. Nous avons exclu les femmes âgées de moins de 15 ans ou de plus de 49 ans, les femmes ayant une grossesse multiple ou les femmes ayant des antécédents d’HTA chronique avant la grossesse, de maladie cardiovasculaire, d’insuffisance rénale, de malformation cardiaque, de maladie inflammatoire ou d’infection VIH avant la grossesse. Les femmes incluses ont été suivies de la fin de leur post-partum (6 semaines après l’accouchement) jusqu’au 31 décembre 2018 ou jusqu’à la survenue d’une HTA, d’un décès ou d’une seconde grossesse.
Exposition aux DHG
Nous avons utilisé différents algorithmes pour identifier les DHG dans le SNDS, à partir des délivrances de médicaments et des codes diagnostiques (CIM-10) utilisés durant les hospitalisations.
L’HG était définie par au moins une délivrance d’un traitement antihypertenseur entre 20 semaines de grossesse et 6 semaines post-partum, ou par une hospitalisation avec un code d’HG (O13). Les traitements antihypertenseurs pouvant être prescrits dans le cadre d’une menace d’accouchement prématuré, les femmes hospitalisées avec ce diagnostic (O47, O60.0-O60.2, O60.9) étaient exclues du groupe HG, afin d’éviter des erreurs de classification. La date de diagnostic d’HG était la date du premier achat d’antihypertenseur ou la date de première hospitalisation avec un code diagnostique O13, qui pouvait être le séjour d’accouchement. La PE et ses complications (HELLP syndrome et éclampsie) étaient identifiées à partir des codes diagnostiques hospitaliers (ICD-10 codes O14, O15). La PE était considérée comme sévère si elle était codée avec le code O14.1 ou si elle était compliquée d’une éclampsie ou d’un HELLP syndrome. Elle était considérée comme précoce si elle survenait avant 34 semaines de grossesse, et comme « PE compliquant une HG » si un diagnostic d’HG était antérieur à celui de PE. Enfin, la PE était considérée comme associée à un petit poids de naissance (PPN) pour l’âge gestationnel si le poids de naissance était inférieur au 10e percentile selon l’âge et le sexe. La durée d’exposition au DHG était calculée comme le nombre de jours entre le diagnostic de DHG et l’accouchement.
Critère de jugement
Au cours du suivi, l’HTA chronique était définie par l’identification d’au moins trois remboursements d’antihypertenseurs à des dates différentes sur une période de 12 mois, ou deux dates si l’un des remboursements comprenait un grand conditionnement (90 comprimés). La date de première délivrance d’antihypertenseur était définie comme la date de diagnostic de l’HTA.
Covariables
L’âge maternel, la Couverture médicale universelle complémentaire (CMUc), les antécédents médicaux et les informations relatives à la grossesse, au post-partum et à la prise en charge médicale des femmes incluses dans l’analyse ont été recueillis dans le SNDS. Le mode d’accouchement, la mort fœtale in utero, l’obésité et les hémorragies de la grossesse ou de la délivrance étaient identifiés à partir du PMSI dans le séjour d’accouchement de la mère. Le tabagisme était identifié par un algorithme combinant les codes diagnostiques hospitaliers du séjour d’accouchement de la mère ou de l’enfant et le remboursement de substituts nicotiniques avant ou pendant la grossesse. Le diabète antérieur à la grossesse était identifié par au moins trois délivrances de médicaments antidiabétiques dans l’année précédant l’accouchement (ou deux délivrances si l’une d’entre elles comprenait un grand conditionnement). Les antécédents d’événements cardiovasculaires et d’insuffisance rénale étaient recherchés jusqu’à 2006 par les codes suivants : I20.0 et I21-I23 pour le syndrome coronarien aigu, I60-I64, O225 ou O873 pour les accidents vasculaires cérébraux et thromboses veineuses cérébrales, I50 pour l’insuffisance cardiaque, I26 et O88.2 pour l’embolie pulmonaire. Le diabète gestationnel était identifié par un algorithme basé sur la délivrance d’insuline ou de bandelettes d’auto-surveillance glycémique, ou un diagnostic de diabète pendant la grossesse sans diabète préexistant.
Le poids de naissance de l’enfant a été identifié à partir du séjour hospitalier de l’enfant qui a été chaîné au séjour d’accouchement de la mère grâce au chaînage mère-enfant. Ce chaînage n’étant possible qu’à partir de 2013, les analyses comportant cette variable ont été restreintes à la période 2013-2018.
Les consultations avec les médecins généralistes, cardiologues, néphrologues, endocrinologues, gynécologues et sages-femmes dans le suivi des femmes ont été identifiées.
Analyses statistiques
Nous avons calculé les prévalences brutes et les courbes de fréquences cumulées d’HTA chronique au cours du suivi, par type de DHG. Les Hazard Ratios bruts et ajustés (HR et aHR) de développer une HTA chronique au cours du suivi ont été estimés par des modèles de Cox pour chaque type de DHG. Ces modèles étaient ajustés sur l’année d’accouchement, l’âge maternel, la CMUc, le diabète gestationnel, l’obésité, le tabagisme et le diabète préexistant. Le poids de naissance n’étant disponible qu’à partir de 2013, les modèles expliquant la survenue d’une HTA chronique selon la présence d’une PE avec petit poids de naissance était restreints à la population des femmes ayant accouché entre 2013 et 2018.
Afin de prendre en compte un possible effet non linéaire de la durée d’exposition aux DHG sur la survenue d’une HTA, nous avons modélisé l’effet de la durée en introduisant des splines naturels (3 nœuds) aux modèles de survie brut et ajustés. À partir de ces modèles, nous avons représenté les courbes de HR en fonction de la durée d’exposition aux DHG, de 0 à 10 semaines pour la PE et de 0 à 20 semaines pour l’HG (période comprenant 99% des durées d’exposition observées).
Enfin, pour étudier les effets spécifiques de la précocité de la PE et de la durée d’exposition de la PE, nous avons réalisé des modèles de Cox modélisant la survenue d’une HTA chez les femmes ayant une PE précoce comparées à celles ayant une PE tardive (brut, ajusté sur les covariables, et ajusté sur la durée d’exposition à la PE et sur les covariables).
Résultats
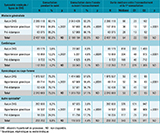
Au total, 2 663 573 femmes de la cohorte Conception ont été incluses dans l’analyse (figure 1) et suivies en moyennes 3,0 ans (quartiles : 1,3-4,2) ; leurs caractéristiques sont résumées dans le tableau 1. Les femmes ayant développé un DHG étaient plus âgées et accouchaient à un âge gestationnel plus précoce. Elles avaient plus de risque d’être obèses, bénéficiaires de la CMUc, diabétiques, et d’avoir une césarienne, une mort fœtale in utero ou une hémorragie de la grossesse ou du post-partum. Au cours du suivi, 47 533 (1,78%) femmes ont développé une HTA chronique ; ce taux était plus élevé chez les femmes ayant eu un DHG (8,69% et 10,84% pour les femmes avec une HG et une PE vs 1,23% pour les femmes sans désordre). La durée moyenne d’exposition aux DHG, c’est-à-dire la durée entre le diagnostic et l’accouchement était de 35,8 jours pour l’HG et 7,8 jours pour la PE. Les HG étaient identifiées dans 80% des cas par les achats d’antihypertenseurs, dans 33% des cas par le code O13 en hospitalisation et dans 13% par ces deux sources.
 Agrandir l'image
Agrandir l'imageLe tableau 2 présente la prévalence brute des différents types de DHG. Parmi les femmes incluses, 180 063 (6,67%) ont eu un diagnostic de DHG durant leur grossesse, 113 803 (4,27%) un diagnostic d’HG, et 66 260 (2,49%) de PE. Parmi ces dernières, 11 666 (17,61%) avaient une PE précoce, 26 921 (40,62%) une PE sévère, 8 665 (13,08%) une PE compliquant une HG et 14 271 (21,54%) une PE avec PPN.
Les courbes d’incidence cumulée d’HTA (figure 2) montrent que la survenue d’une HTA était plus précoce et plus importante chez les femmes avec une HG ou une PE que chez les femmes sans DHG. Les modèles de survie (tableau 3) montraient que les femmes avec DHG avaient plus de risque de développer une HTA que celles sans DHG (aHR=6,77, IC95%: [6,64-6,90], p<0,0001). Ce risque était plus élevé chez les femmes avec une PE (8,10 [7,88-8,33], p<0,0001) que chez celles ayant une HG (6,03 [5,89-6,17], p<0,0001). Comparés aux femmes sans DHG, les HR ajustés de développer une HTA étaient de 9,90 [9,53-10,28] pour les femmes avec une PE sévère, 12,95 [12,29-13,65] pour les femmes avec une PE précoce, 13,17 [12,74-13,60] pour les femmes avec une PE compliquant une HG, et 12,49 [11,76-13,27] pour les femmes avec une PE avec PPN.
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageLes modèles de Cox avec spline naturel sur la durée d’exposition aux DHG montraient que le risque de développer une HTA augmentait de manière continue et significative avec la durée d’exposition à la PE (figure 3). Cet effet était plus important pour la PE sévère et la PE avec PPN. À l’inverse, l’impact de la durée d’exposition à l’HG sur la survenue d’une HTA était faible et fluctuant.
 Agrandir l'image
Agrandir l'imageComparée à la PE tardive, la PE précoce était associée à une augmentation de risque d’HTA (1,80 [1,71-1,90], p<0,0001). Quand la durée d’exposition à la PE était ajoutée comme variable d’ajustement, l’association entre la PE précoce et l’HTA persistait mais était atténuée (1,69 [1,61-1,79], p<0,0001) (figure 4).
vs pré-éclampsie tardive
 Agrandir l'image
Agrandir l'imageDurant l’année suivant l’accouchement, 2 198 194 (82,5%) femmes ont consulté un médecin généraliste (tableau 4), 30 343 (1,1%) un cardiologue, 1 519 700 (57,1%) un gynécologue ou une sage-femme et 1 165 10 (4,4%) un médecin d’une autre spécialité (i.e. neurologue, endocrinologue, néphrologue). La durée médiane entre l’accouchement et la première consultation était d’environ 2 mois pour un médecin généraliste et un gynécologue ou une sage-femme (64 et 53 jours). Les femmes ayant eu une PE consultaient un gynécologue ou une sage-femme plus rarement et plus tardivement que les femmes sans PE (p<0,0001). Cependant, les femmes ayant eu un DHG, et particulièrement les femmes avec PE, consultaient plus fréquemment et plus précocement un médecin d’une autre spécialité (p<0,0001).
par type de désordre hypertensif de grossesse
 Agrandir l'image
Agrandir l'imageDiscussion
Cette cohorte prospective nationale de plus de 2,6 millions de femmes primipares françaises nous a permis d’évaluer la survenue d’une HTA selon différents types de DHG. Nous avons mis en évidence que le risque d’HTA chronique augmentait grandement et rapidement dans les années suivant l’accouchement chez les femmes ayant eu une HG (aHR=6,03) ou une PE (8,10). Cet excès de risque était encore plus élevé chez les femmes ayant une PE précoce, une PE sévère ou une PE compliquant une HG. La durée d’exposition à la PE était un facteur de risque d’HTA, mais cet effet n’était pas retrouvé pour l’HG.
Plusieurs études antérieures ont montré que les femmes ayant des antécédents de DHG, particulièrement de PE, avaient un risque augmenté de développer une HTA chronique ou une maladie cardiovasculaire 12,13,18. Certains auteurs ont montré que ce sur-risque était encore plus grand en cas de PE précoce ou associée à un PPN 19. Toutefois, peu d’auteurs se sont intéressés à l’HG. Plusieurs facteurs de risque de DHG, par exemple les antécédents familiaux d’HTA, l’obésité ou le diabète sont aussi des facteurs de risque connus d’HTA chronique. Il est donc difficile de dire si ces facteurs de risque partagés expliquent à la fois la survenue des DHG puis de l’HTA chronique, ou s’il existe une relation de causalité entre les DHG et l’HTA chronique 20. Étant donné que nos modèles étaient ajustés sur les principaux facteurs de risque d’HTA, notamment l’obésité et les antécédents cardiovasculaires, la seconde hypothèse semble la plus probable. Celle-ci est renforcée par la relation significative entre la durée d’exposition à la PE et la survenue d’une HTA chronique. À notre connaissance, ce résultat n’a jamais été rapporté précédemment, contrairement aux effets des différents phénotype de PE (sévère ou précoce) sur le risque de développer une HTA à distance de l’accouchement 21,22. De même, la PE compliquant une HG est rarement étudiée dans la littérature internationale, où elle est souvent incluse dans le groupe PE. La puissance statistique de notre étude a permis d’étudier ce groupe spécifique de DHG (n=8 865) et de montrer son association à un sur-risque d’HTA chronique.
En France, afin d’éviter un sous-diagnostic des complications chroniques des DHG, la société française d’HTA (SFHTA) recommande aux femmes ayant eu un DHG de réaliser une consultation d’annonce à distance de l’accouchement 2. Les objectifs de cette consultation sont d’expliquer le lien avec la survenue future de maladies cardiovasculaires et rénales, d’insister sur l’importance d’un suivi multidisciplinaire, et d’assurer la mise en place de mesures de prévention. La SFHTA recommande également d’effectuer un suivi tensionnel au long cours, même en cas de retour des chiffres de pression artérielle à la normale après l’accouchement, et une évaluation des autres facteurs de risque cardiovasculaire. Dans notre étude, 86% des femmes ayant eu une HG ou une PE consultaient leur médecin généraliste au cours de l’année suivant l’accouchement. Le dépistage de l’HTA chronique chez ces femmes pourrait être amélioré en insistant sur l’importance du suivi tensionnel auprès des médecins impliqués dans la prise en charge, notamment les médecins généralistes et les médecins du travail.
La principale force de cette étude est la quasi-exhaustivité des données à l’échelle nationale, rendue possible par l’utilisation du SNDS (99,6% des naissances en France) 6. Cette exhaustivité a permis d’assurer une puissance statistique optimale et d’étudier chaque sous-type de DHG. Nous avons également pu analyser l’impact de la durée d’exposition aux HDP sur la survenue d’une HTA. Notre étude présente aussi des limites. L’HTA étant principalement identifiée via les remboursements d’antihypertenseurs, la proportion de femmes ayant développé une HTA est probablement sous-estimée. Une évaluation antérieure de ces algorithmes montrait que les médecins pouvaient ne pas traiter les HG non sévères (i.e. <160/110 mmHg), afin d’éviter une hypoperfusion placentaire 6. Certaines femmes ayant une HG modérée non codée durant l’hospitalisation de naissance ont donc pu être classées parmi les femmes sans DHG, entraînant une sous-estimation des risques d’HTA pour tous les groupes de DHG. De la même façon, la pré-éclampsie a pu être sous-estimée par un défaut de codage dans le PMSI. Si un tel biais existe, il est probablement de faible amplitude étant donné le très bon niveau de performance du PMSI dans l’identification des événements maternels, comme l’ont montré Chantry et coll. 23. Enfin, certains facteurs de confusion mal renseignés dans le SNDS ont insuffisamment été pris en compte. C’est le cas, notamment pour l’obésité et le tabagisme maternel 24. De même, la consommation d’alcool et les antécédents familiaux d’HTA n’étaient pas disponibles dans le SNDS et n’ont pas pu être pris en considération dans les modèles.
Conclusion
Chez les femmes primipares, les DHG étaient associés à un sur-risque important de survenue d’une HTA chronique dans les années suivant l’accouchement. Des recherches complémentaires sont nécessaires pour comprendre les mécanismes par lesquels les DHG augmentent le risque d’HTA après l’accouchement. Un suivi tensionnel et des mesures de prévention cardiovasculaire devraient être renforcées chez ces personnes, particulièrement chez les femmes ayant eu une PE sévère, précoce, ou compliquant un HG.