Tabagisme et diabète : le temps de l’action
// Smoking and diabetes: Time for action
Résumé
Les études épidémiologiques montrent un lien clair entre tabagisme (actif ou passif) et le risque de développer un diabète de type 2 (DT2). Le tabagisme majore la mortalité toutes causes ainsi que le risque de complications macro- et micro-angiopathiques (néphropathie chez le patient DT2, rétinopathie et neuropathie chez le diabétique de type 1), il participe au déséquilibre glycémique et favorise le diabète gestationnel. Prévenir le tabagisme chez le sujet à risque de DT2 et promouvoir le sevrage tabagique chez le patient DT2 constituent donc une priorité de santé publique selon un récent consensus d’experts publié par la Société francophone de tabacologie (SFT) et la Société francophone du diabète (SFD).
Abstract
Epidemiologic studies demonstrate a clear link between active or passive smoking and the risk of developing a type 2 diabetes (T2D). Cigarette smoking increases all-cause mortality as well as the risk of macro and microvascular complications (i.e. nephropathy in T2D patient, retinopathy and neuropathy in type 1 diabetes), it alters glycemic control and favours gestational diabetes mellitus. Preventing cigarette smoking in patients at risk of T2D and promoting smoking cessation in T2D patients are public health priorities, as recently concluded in a joint position statement by the French-Speaking Society on Tobacco (Société francophone de tabacologie) and the French-Speaking Society of Diabetes (Société francophone du diabète).
Introduction
Le diabète de type 2 (DT2) et le tabagisme s’inscrivent dans le champ des maladies chroniques et constituent deux problèmes de santé publique majeurs ; ils réduisent l’un et l’autre sensiblement l’espérance de vie (10 ans en moyenne pour le tabagisme, 6 ans pour le DT2) et évoluent de manière épidémique 1.
Plus de 1 milliard d’hommes et 250 millions de femmes fument et l’évolution du diabète est épidémique (touchant plus de 537 millions d’individus en 2021). Le DT2 est le plus fréquent, son évolution est satellite de celle de l’obésité abdominale touchant de 4 à 10 % de la population 2. La prévalence du tabagisme dans le monde est de l’ordre de 20,8% chez la personne DT2 et varie selon les populations. Elle représente de 10 à 30% environ des personnes DT1. En France, les données de l’étude Échantillon national témoin représentatif des personnes diabétiques (Entred), en cours de réévaluation, montrent une prévalence de 13% chez les personnes DT2 et 39% chez les personnes DT1 3 sachant que la prévalence du tabagisme dans la population générale est de 24%.
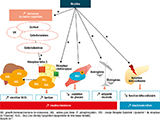
Il est plus fréquent chez les hommes jeunes, augmente chez les femmes, et est inversement corrélé au statut socioéconomique des patients, avec une prévalence plus importante chez les patients les plus précaires (figure 1).
Tabagisme, composition corporelle, insulinorésistance et insulinosécrétion | 4 |
Il existe un lien très probable entre le tabagisme et l’accumulation de graisse viscérale qui fait le lit du syndrome métabolique associant variablement DT2, hypertension artérielle, hypertriglycéridémie et baisse du HDL-cholestérol survenant dans un contexte d’insulinorésistance.
En effet, si le fumeur a en moyenne un poids inférieur à celui du non-fumeur, il présente en revanche un excès de tissu adipeux abdominal avec un rapport taille/hanche plus élevé qui s’associe à une dégradation de la tolérance au glucose et des index d’insulinosensibilité 5.
Ses mécanismes sont discutés, mais font intervenir des effets :
–liés à la nicotine (principalement étudiée) : stimulation de la production d’hormones de contre-régulation glycémiques (catécholamines, cortisol, hormone de croissance), effet anti-œstrogènes (figure 2) ;
–pro-inflammatoires de la fumée de tabac induisant une inflammation de bas grade ;
–de dysfonction endothéliale liée au stress oxydatif et conséquences de l’hypoxie causée par le monoxyde de carbone (CO).
Un rôle possible des métaux lourds contenus dans la fumée de cigarette (arsenic, plus que plomb, mercure ou cadmium) a également été évoqué, sachant que la fumée de tabac contient de l’ordre de 4 700 substances.
Cette insulinorésistance est favorisée par le tabagisme actif (+ 40 %) mais également par le tabagisme passif (+ 28 %). Des facteurs génétiques de prédisposition touchant en particulier le récepteur cholinergique à la nicotine pourraient également intervenir. L’insulinorésistance est réversible lors de l’arrêt du tabagisme 6.
Mécanismes moléculaires
–diminution de l’expression de PPAR gamma, augmentation de la phosporylation du récepteur de l’insuline (qui diminue l’insulinosensibilité), augmentation de la lipolyse du tissu adipeux et de la sécrétion des Very Low-Density Lipoprotein (VLDL) (lipoprotéines de très basse densité) hépatiques ;
–activation de la sous-unité alpha-7 du récepteur cholinergique à la nicotine ;
–anomalies épigénétiques par méthylation aberrante du DNA de gènes impliqués dans le risque de DT2.
En ce qui concerne l’insulinosensibilité : des récepteurs nicotiniques ont été identifiés au niveau des terminaisons pré-synaptiques sympathiques des îlots bêta-pancréatiques et des récepteurs post-synaptiques. Le tabagisme est associé à une diminution de la fonction bêta-cellulaire mais les potentiels mécanismes, médiés par la nicotine qui augmenterait l’apoptose des cellules bêta, restent insuffisamment documentés.
Tabagisme et DT2
Les données de nombreuses études d’observation suggèrent que le risque relatif de prédiabète et de DT2 est augmenté de 37 à 44% chez les fumeurs par rapport aux non-fumeurs dans différentes populations (caucasiennes, asiatiques…) 7,8. Ce risque augmente de manière dose-dépendante 7 et a été confirmé par plusieurs méta-analyses récentes 9 sur des données prospectives ; à l’opposé ce risque diminue avec l’arrêt de consommation de tabac, notamment après 10 ans de sevrage. De manière intéressante le risque de DT2 semble plus marqué chez les hommes que chez les femmes fumeuses dans certaines cohortes, sans explications claires à ce phénomène. Le tabac apparaît donc comme un facteur de risque indépendant et modifiable de DT2 dans la population générale 3.
Notons également un surcroît de risque de DT2 lié pour 68% à la prise de poids lors du sevrage tabagique chez le non-diabétique ; celui-ci est d’autant plus marqué 5 à 7 ans après le sevrage, est proportionnel à l’importance de la prise de poids, et décroît progressivement dans le temps pour rejoindre un risque équivalent à celui du non-fumeur uniquement après 30 ans de sevrage 10.
Tabagisme, mortalité et complications du diabète
Chez le DT2, comme chez le DT1 le tabagisme actif constitue le principal facteur de risque de mortalité toutes causes avant même l’équilibre glycémique, lipidique ou tensionnel 11. Le bénéfice du sevrage sur ce risque de mortalité toutes causes est d’autant plus important que le sevrage aura été précoce.
Chez le patient DT1 et DT2 le tabagisme actif est également un facteur de risque des complications macro-angiopathiques du diabète (infarctus du myocarde, accident vasculaire cérébral (AVC), artériopathie des membres inférieurs), et le risque augmente de manière dose-dépendante (figure 3). Chez le patient DT2, une méta-analyse a montré que les risques de mortalité cardiovasculaire, de morbidité cardiovasculaire et de coronaropathie étaient de 1,49 (intervalle de confiance à 95% : IC95%: [1,29‑1,71]), 1,44 [1,34-1,54] et 1,51 [1,41-1,62], respectivement. Une relation dose-dépendante a également été établie dans une étude prospective réalisée chez des infirmières diabétiques (Nurse’s Health Study) et dans une étude chinoise récente. On retrouve donc une association positive et dose-dépendante entre le tabagisme et le risque coronarien chez les patients DT2. Dans la méta-analyse de Pan et coll., les risques de survenue d’AVC et d’artériopathie périphérique étaient de 1,54 [1,41‑1,69], et 2,15 [1,62‑2,85] chez les patients fumeurs 3.
En ce qui concerne la micro-angiopathie (néphropathie, rétinopathie, neuropathie) le rôle du tabagisme comme facteur de risque potentiel de rétinopathie diabétique est établi chez les patients atteints de DT1, mais discuté chez les patients atteints de DT2. Il est connu un comme un facteur de risque de la néphropathie diabétique chez le DT2. Il existe enfin une association positive entre tabagisme et neuropathie diabétique prouvée dans le DT1, mais discutée dans le DT2 12. Dans une méta-analyse récente portant sur 82 études, le risque de rétinopathie diabétique était augmenté chez les fumeurs DT1 (risque relatif : RR=1,23 ; IC95%: [1,14-1,33], p < 0,001), mais diminué chez les fumeurs DT2 (RR=0,92 ; IC 95%: [0,86-0,98], p=0,02). Chez le diabétique de type 2, dans une méta-analyse récente portant sur 13 études transversales ou prospectives, le risque de microalbuminurie était augmenté chez les patients fumeurs (odds ratio : OR=2,13 (IC95%: [1,32-3,45]; p=0002) et il existait ainsi une relation linéaire entre le tabagisme et la durée du DT2 avec l’albuminurie 3.
Les mécanismes impliqués dans l’aggravation des complications micro- et macro-angiopathiques sont complexes et intriqués : liés à l’insulinorésistance (hypertriglycéridémie, diminution du HDL-cholestérol, peroxydation des LDL…), ainsi qu’à la dysfonction endothéliale associant spasme et thrombose favorisée par l’hypoxie (CO-dépendante) et à l’inflammation de la paroi artérielle.
Autres complications | 3 |
La consommation de tabac chez les sujets diabétiques (la majorité des données concernant les DT2) est associée à un surrisque de survenue de cancer avec un risque relatif fumeur/non-fumeur de l’ordre de 1,6 ; elle est également liée à un excès de mortalité par cancer avec un risque relatif fumeur/non-fumeur de l’ordre de 1,4, et cet excès décroît avec le sevrage tabagique.
Les sujets diabétiques fumeurs actuels ont également un risque plus élevé d’hospitalisation pour infection par rapport aux sujets diabétiques non-fumeurs, et ce avec un risque relatif de l’ordre de 1,3.
Le tabagisme est associé à un risque d’amputation plus élevé chez les patients diabétiques avec un pied infecté.
La consommation du tabac chez les sujets diabétiques est associée à un risque accru de survenue et de progression de parodontopathies.
Tabagisme, diabète, et dépression | 13,14 |
Le DT2, plus volontiers dépressif que le non-diabétique, l’est d’autant plus qu’il fume plus de 11 cigarettes/jour. Il existe une relation positive entre le nombre de cigarettes fumées et la sévérité du syndrome dépressif ; de plus, le tabagisme s’associe à une dégradation de la qualité de vie du patient diabétique ainsi qu’a une augmentation des comorbidités. La fréquente présence d’un syndrome dépressif chez le diabétique rend le sevrage d’autant plus difficile à appréhender.
Le tabagisme apparaît donc comme un facteur de risque indépendant de dépression chez le patient DT2, et la prévention du tabagisme doit être considérée afin de limiter le risque de développement d’une symptomatologie dépressive.
Chez le patient DT1, les données sont limitées et ne permettent pas de conclure.
Tabagisme, diabète et femme
Le tabagisme pendant la grossesse est associé à une augmentation du risque de diabète gestationnel (DG) chez la femme fumeuse (OR=1,65), puis de diabète patent ; à l’opposé, l’absence de tabagisme et le sevrage du tabac (associée aux règles hygiéno-diététiques) diminuent le risque de diabète gestationnel.
Le tabagisme maternel majore le risque de retard de croissance intra-utérin, de fausse couche précoce, de grossesse extra-utérine, d’anomalie congénitale, d’hématome rétroplacentaire, de placenta prævia, de prématurité, de mort fœtale in utero, de césarienne, de petit poids de naissance lui-même facteur de risque de surpoids, d’obésité abdominale et de DT2 pour l’enfant probablement par des mécanismes épigénétiques 15.
Dans un contexte de diabète gestationnel chez les femmes fumeuses, l’équilibre glycémique apparaît globalement moins bon avec une plus grande fréquence d’instauration d’une insulinothérapie.
De plus les enfants de femmes fumeuses ont un risque de DT2 augmenté de 34% en cas de tabagisme actif et de 22% en cas de tabagisme passif.
L’association tabagisme, obésité et DT2 est par ailleurs responsable de l’augmentation préoccupante de l’incidence de la maladie coronarienne chez la femme 16.
Dans le DT1, nous manquons de données.
Tabagisme et équilibre glycémique | 3 |
L’HbA1c (hémoglobine glyquée) est plus élevé chez les fumeurs actifs (+ 0,12% par 20 paquets/année) non DT2 et les ex-fumeurs (+ 0,03 %) que chez les non-fumeurs. L’augmentation d’HbA1c observée est corrélée à celle de la cotinine urinaire (catabolite de la nicotine). Chez les patients DT1, DT2 et les patientes porteuses d’un DG, le tabagisme actif est associé à une détérioration de l’équilibre glycémique avec une relation dose-dépendante en fonction de la sévérité du tabagisme.
Lorsque le diabétique est traité et qu’il est fumeur son équilibre glycémique est de moins bonne qualité ; s’il est traité par l’insuline, une résorption retardée de l’insuline pourrait participer à un équilibre glycémique plus instable ; l’instabilité glycémique est plus fréquente en particulier chez le DT1, le risque d’hypoglycémies sévères est augmenté.
L’ensemble de ces éléments souligne donc :
–l’intérêt de ne pas devenir fumeur lorsque l’on est à risque de diabète afin de prévenir la survenue d’un diabète gestationnel ou d’un diabète patent ;
–la nécessité du sevrage tabagique chez les patients DT1 et DT2 fumeurs pour diminuer la mortalité toutes causes et/ou cardiovasculaire, et pour réduire et/ou limiter les complications micro-angiopathiques (tableau).
 Agrandir l'image
Agrandir l'imageSevrage tabagique chez le diabétique | 3 |
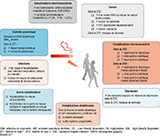
Les recommandations actuelles (European Society of Cardiology (ESC) – European Association For the Study of Diabetes (EASD)) soulignent l’intérêt et la nécessité du sevrage tabagique chez les sujets prédiabétiques ou diabétiques 17, même si cette mesure thérapeutique essentielle n’est pas suffisamment prise en considération par les professionnels de santé en diabétologie.
Il ne fait cependant l’objet que de peu d’études reposant sur des interventions psycho-comportementales (intervention brève, entretien motivationnel (EM), soutien téléphonique, autosupport numérique, activité physique, éventuellement intégrés dans des programmes d’éducation thérapeutique) associées ou non à une intervention pharmacologique (substitution nicotinique (SN), utilisation de bupropion ou de varénicline) 18.
Ainsi l’EM montre un bénéfice, avec 1,4 à 7 fois plus de sevrage du tabac chez les patients DT1 et DT2. Soulignons que 85% des études ayant montré un bénéfice de l’EM, proposent des aides pharmacologiques dans le groupe intervention, ce qui ne permet pas de juger de l’efficacité de l’EM seul dans le sevrage tabagique.
L’étude de Canga et coll. 19 montre dans un groupe de 280 DT2 qu’une intervention d’aide au sevrage pratiquée par une infirmière tabacologue associant entretien, SN si nécessaire et suivi personnalisé permet une réduction significative de la consommation tabagique à 6 mois, et ce par rapport aux soins habituels de simples conseils d’arrêt (17,0% vs 2,3%, p<0,001). Des études d’intervention thérapeutique portant sur des effectifs plus larges de patients diabétiques sont donc ici nécessaires, en l’absence de données spécifiques et de qualité suffisante sur l’efficacité et la tolérance chez les patients DT1 et DT2. Il existe un accord des spécialistes pour considérer la transposition des résultats des évaluations venant de la population générale non-diabétique fumeuse vers celle des diabétiques fumeurs (tableau).
Chez les patients diabétiques, l’arrêt du tabac doit être associé à des mesures hygiéno-diététiques renforcées, notamment dans les premières années suivant l’arrêt. Aucune donnée à ce jour ne permet de recommander la modification du traitement à visée antidiabétique préalablement au sevrage. Dans l’année suivant le sevrage une surveillance renforcée des paramètres glycémiques et du poids est nécessaire.
Le sevrage tabagique se heurte par ailleurs comme chez les non-diabétiques à la question sensible de la prise de poids, susceptible de dégrader l’équilibre glycémique et contre laquelle le patient diabétique est sensibilisé en permanence. Une méta-analyse portant sur 62 études 20 a montré que celle-ci, bien que fréquente (prise de 4 à 5 kg après 12 mois d’abstinence), survient essentiellement dans les six premiers mois suivant le sevrage, n’est pas inéluctable (de 16 à 21% des sujets perdent du poids), ceci quels que soient les traitements utilisés (substitution nicotinique, bupropion, varénicline). Elle semble être plus importante chez les femmes que chez les hommes, mais les données de la littérature sont limitées et parfois contradictoires.
De plus, le bénéfice du sevrage tabagique essentiellement évalué chez le DT2, en particulier sur le plan de la mortalité totale et cardiovasculaire est significativement supérieur sur le long terme au réel inconvénient représenté par la prise de poids et/ou la dégradation de l’équilibre glycémique chez le diabétique.
Conclusion
Le tabagisme constitue un facteur de risque démontré de pré-diabète, de DT2 et de DG. Il est associé à une dégradation de l’équilibre glycémique. Il constitue également la première cause de mortalité chez les DT2 et est un déterminant majeur des complications micro-angiopathiques (néphropathie) et macro-angiopathiques. Il y a donc un bénéfice majeur à décourager toute consommation tabagique chez le patient à risque de diabète (prévention primaire), ou à l’aider à se sevrer s’il est déjà diabétique et fumeur (prévention secondaire). Compte-tenu du peu d’études sur la stratégie spécifique de prise en charge thérapeutique du sevrage tabagique chez les patients diabétiques, l’application des mêmes principes qu’en population générale est donc recommandée, en combinant des thérapeutiques psycho-comportementales et pharmacologiques (tableau). Une sensibilisation et une formation à l’aide au sevrage tabagique des équipes éducatives diabétologiques sont par ailleurs indispensables.
Remerciements
Dans le cadre du groupe de travail Tabagisme et diabète, l’auteur tient à remercier Stéphanie Genou-Vannobel et Isabelle Gaudy (infirmières tabacologues) pour leurs conseils pertinents, ainsi que Laura Phirmis et Claude Chaumeil de la Fédération française des diabétiques (FFD) pour leurs conseils judicieux.
Liens d’intérêt
L’auteur déclare ne pas avoir de liens d’intérêt au regard du contenu de l’article. Il déclare par ailleurs avoir participé à des essais cliniques pour les laboratoires Amgen, Sanofi, Bioprojet, à des conférences, colloques ou actions de formation pour les laboratoires Amgen, Sanofi et Servier, MSD et pour Preuves & Pratiques, et avoir été pris en charge (transport, hôtel, repas), à l’occasion de déplacements pour congrès, par les laboratoires Servier, Amgen, Sanofi, Novo Nordisk.