Portage d’entérobactéries productrices de bêta-lactamases à spectre élargi par des migrants mineurs non accompagnés, lors de leur première consultation au centre hospitalier universitaire d’Angers
// Carriage of extended-spectrum beta-lactamase-producing enterobacteria in unaccompanied refugee minors at the time of their first medical consultation in Angers teaching hospital
Résumé
Introduction –
La prévalence du portage d’entérobactéries productrices de bêta-lactamases à spectre élargi (EBLSE) est forte parmi les réfugiés et demandeurs d’asile arrivant en Europe. Notre objectif était d’étudier le portage d’entérobactéries productrices de bêta-lactamases à spectre élargi et de bactéries hautement résistantes aux antibiotiques et émergentes (BHRe) par des migrants mineurs non accompagnés (MNA), lors de leur arrivée à Angers, et aussi d’identifier de possibles clusters parmi ces bactéries.
Matériels et méthodes –
Une étude observationnelle a été conduite pendant dix-huit mois et a concerné tous les MNA arrivant à Angers. Des échantillons de selles ont été ensemencés sur des milieux de culture gélosés sélectifs directement et après enrichissement par des bouillons supplémentés en antibiotiques. Les mécanismes de résistance ont été identifiés par différentes méthodes : disques combinés, immuno-chromatographie et PCR. Les isolats ont été comparés par électrophorèse en champ pulsé. Des données cliniques et administratives concernant les MNA ont été recueillies.
Résultats –
Au total, 139 MNA ont été inclus dans l’étude. La plupart d’entre eux (74,1%) étaient originaires d’Afrique. Les principaux points d’arrivée en Europe étaient les Balkans (20,1%), l’Italie (28,1%) et la péninsule Ibérique (38,1%). La prévalence des EBLSE était de 25,7% (intervalle de confiance : IC95%: [18,4%-33,0%]). Aucune BHRe n’a été isolée. L’analyse des isolats d’Escherichia coli par électrophorèse en champ pulsé a permis d’identifier 4 clusters. Dans ces clusters, la prise en compte de données concernant le trajet de chaque MNA a permis de suggérer l’hypothèse d’une transmission d’EBLSE après leur arrivée à Angers.
Discussion-conclusion –
La possibilité d’une contamination des MNA dans les premières semaines suivant leur arrivée pourrait conduire à revoir les conditions d’hébergement qui leur sont proposées en début de séjour.
Abstract
Introduction –
High prevalence of extended-spectrum beta-lactamase-producing Enterobacteriaceae (ESBL-PE) has been described in refugees arriving in European countries. Our objective was to study the carriage of ESBL-PE and highly-resistant and emerging bacteria (HREB) in unaccompanied refugee minors (URM) arriving in Angers and to identify possible clusters of close-related isolates.
Materials and methods –
An observational study was conducted during 18 months and concerned all the URM who arrived in Angers. Stool swabs were inoculated onto selective agar media directly and after enrichment in a broth supplemented with antibiotics. ESBL-PE and HREB production was identified by appropriate combine-disk tests. Isolates were compared by pulsed-field gel electrophoresis (PFGE). Clinical and administrative data were recorded with a questionnaire.
Results –
Overall, 139 URM were included in the study. Most of them (74.1%) were from Africa. Major travel routes passed through the Balkans (20.1%), Italy (28.1%) and Iberian Peninsula (38.1%). The prevalence of ESBL-PE was 25.7% (a 95% confidence interval: CI95%: [18.4%-33.0%]). No HBRE was identified. The analysis of Escherichia coli by PFGE identified 4 clusters. In these clusters, the analysis of the countries of origin of URM, length of travels, travel routes and dates of the first medical consultation in Angers allowed to suggest that ESBL-PE transmission could occur after their arrival.
Discussion-conclusion –
The occurrence of ESBL-PE transmission within the first weeks following the arrival of URM could lead to reconsider the accommodation arrangements that are offered at the beginning of their stay.
Introduction
Les guerres, les persécutions politiques et l’instabilité rencontrée dans certains pays font qu’un nombre croissant de migrants en provenance du Proche et du Moyen-Orient, d’Asie du Sud et d’Afrique cherchent asile en Europe 1,2. À la fin de l’année 2018, d’après le Haut Commissariat des Nations unies pour les réfugiés, 6 millions et demi de migrants et réfugiés vivaient en Europe 3. Différentes études ont montré que la prévalence de la colonisation par des entérobactéries productrices de bêta-lactamases à spectre élargi (EBLSE) était élevée parmi ces réfugiés, alors que la prévalence du portage de bactéries hautement résistantes aux antibiotiques et émergentes (BHRe), comme les entérobactéries productrices de carbapénémases (EPC) et Enterococcus faecium résistant aux glycopeptides (ERG), restait souvent très faible 2,3,4,5,6,7.
Peu de données sont disponibles sur le portage de ces bactéries résistantes en France. Or, la proportion de migrants venant d’Afrique ou d’Asie n’est pas la même en France et dans les pays anglo-saxons. Il semble donc difficile d’extrapoler les résultats des études réalisées dans ces pays en les comparant à la situation en France. Parallèlement, peu d’études se sont intéressées au lieu d’acquisition de ces EBLSE et, à notre connaissance, aucune n’a pu montrer clairement si ces bactéries avaient été acquises dans le pays d’origine des migrants, dans les pays traversés au cours de leur voyage, ou dans leur pays de destination. La raison principale de la méconnaissance du lieu d’acquisition est l’absence d’analyse combinée de données de typage moléculaire et des dates et périodes auxquelles les migrants auraient pu être en contact avec ces bactéries 6.
L’objectif de cette étude était de déterminer la prévalence de la colonisation par EBLSE ou BHRe chez les migrants mineurs non accompagnés (MNA) lors de leur première consultation au CHU d’Angers, qui intervient généralement entre deux et quatre semaines après leur arrivée dans le département du Maine-et-Loire. Un autre objectif était d’identifier des clusters potentiels d’isolats étroitement reliés parmi ces bactéries résistantes. Le choix des migrants mineurs non accompagnés était motivé par l’organisation de leur prise en charge médicale dans le département facilitant l’exhaustivité des inclusions.
Matériel et méthodes
Dans le cadre du protocole de prise en charge des mineurs migrants arrivant dans le département du Maine-et-Loire sans tuteur légal (parent ou famille), ceux-ci sont convoqués au CHU (centre hospitalier universitaire) d’Angers pour un examen parasitologique des selles, puis pour une consultation dans les deux à quatre semaines suivant leur arrivée. Lors de cette consultation, un traitement est proposé en cas de parasitose digestive. Parallèlement, un questionnaire comportant des données cliniques, démographiques, des informations concernant le pays d’origine, les dates de départ et d’arrivée, et aussi l’itinéraire emprunté, est rempli avec un éducateur et remis au médecin pour adapter la prise en charge médicale et le suivi du migrant. Toujours dans le cadre de leur prise en charge définie par les services départementaux, les migrants mineurs non accompagnés sont hébergés à l’hôtel en chambres doubles ou triples depuis leur arrivée jusqu’à la date de leur consultation.
Pour la présente étude, l’ensemble des MNA pris en charge à Angers entre septembre 2019 et juin 2021 ont été inclus, en accord avec le département lors de leur prise en charge initiale au sein des services départementaux (notamment concernant la réalisation d’analyses supplémentaires sur les échantillons et données recueillies dans le cadre du soin). Pour l’ensemble des MNA, les selles obtenues pour l’examen parasitologique ont été prélevées à l’aide d’un écouvillon pour rechercher les EBLSE et les BHRe. Une information a également été donnée individuellement au migrant au moment de la consultation médicale. À cette occasion, un accord était demandé au MNA concernant l’utilisation de données spécifiques sur sa migration. Les informations recueillies pour l’étude ont été extraites du questionnaire utilisé dans le parcours de santé du migrant. Les pays d’origine ont été regroupés en régions d’après le standard M49 des Nations unies 8.
Au total, l’étude n’a ajouté que l’écouvillonnage à partir de selles déjà obtenues pour des analyses de soins courants définis entre les médecins du CHU (centre hospitalier universitaire) et les médecins des services départementaux. Les écouvillons ont été jetés immédiatement après analyse, sans constitution d’une biothèque. L’ensemble de la démarche est schématisé sur la figure 1.
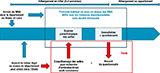 Agrandir l'image
Agrandir l'imageToutes les données et les échantillons ont été anonymisées. L’étude a obtenu l’agrément du Comité d’éthique du CHU d’Angers, et une déclaration a été déposée à la Commission nationale de l’informatique et des libertés (Cnil).
Les écouvillons contenant les échantillons de selles ont été ensemencés sur des milieux de culture gélosés sélectifs pour isoler des bacilles à Gram négatif résistants aux céphalosporines de troisième génération (BLSE, laboratoire bioMérieux, Marcy-l’Étoile), des entérobactéries productrices de carbapénémases (EPC, ChromID® Carba Smart, laboratoire bioMérieux, Marcy-l’Étoile) et des ERG (entérocoques résistant à la vancomycine, Brillance® VRE, Oxoid, Basingstoke, Royaume-Uni). Parallèlement, les écouvillons ont été ensemencés dans trois bouillons d’enrichissement supplémentés par, respectivement, du céfotaxime (2 µg/mL), de l’ertapénem (1 µg/mL) et de la vancomycine (4 µg/mL). Les bouillons ont été ensemencés après vingt-quatre heures d’incubation sur les milieux de culture gélosés sélectifs correspondants. Les colonies isolées sur ces milieux gélosés ont été identifiées par spectrométrie de masse avec la technologie Maldi-Tof (Vitek® MS, laboratoire bioMérieux, Marcy-l’Étoile). La production de BLSE a été mise en évidence par la méthode des disques combinés (groupe médical Rosco Diagnostica, à Taastrup, Danemark). La production de carbapénémases a été identifiée par immuno-chromatographie (Coris Resist-4 OKNV, Auderghem, Belgique) et par la méthode des disques combinés (Rosco). En cas d’isolement d’E. faecium sur le milieu sélectif Brillance® VRE, une détection des gènes vanA/vanB a été réalisée par une méthode PCR en temps réel à l’aide du système GeneXpert (Xpert vanA/vanB, laboratoire Cepheid, à Sunnyvale, États-Unis). Les EBLSE ont été comparées par électrophorèse en champ pulsé, et les isolats ont été catégorisés d’après les critères de Tenover et coll. 9. Les isolats présentant un pourcentage d’homologie supérieur à 80% ont été considérés comme étroitement reliés et ont été classés en clusters.
La prévalence du portage de bactéries résistantes a été exprimée en pourcentage avec intervalle de confiance à 95%. Les prévalences du portage chez les migrants en fonction de leur région d’origine (standard M49), ou de leur itinéraire de migration, ont été comparées avec le test du Chi2.
Résultats
Au total, 139 migrants mineurs non accompagnés ont été inclus dans l’étude. Parmi eux, 103 (74,1%) venaient d’Afrique, et 36 (25,9%) étaient originaires d’Asie du Sud (Pakistan, Inde, Bangladesh). Plus précisément, pour ce qui concerne l’Afrique, et d’après le standard M49 des Nations unies 9, 64 migrants venaient d’Afrique de l’Ouest, 21 d’Afrique du Nord, 12 d’Afrique centrale, et 6 d’Afrique de l’Est. Les principales voies de migrations terrestres empruntées par les migrants depuis leur pays d’origine passaient, lors de leur entrée en Europe, par les Balkans (20,1%, avec 35,7% de MNA porteurs d’EBLSE), l’Italie (28,1%, avec 20,5% de MNA porteurs d’EBLSE), et la péninsule Ibérique (38,1%, avec 16,7% de MNA porteurs d’EBLSE) (figure 2). Parallèlement, 13,7% des migrants sont arrivés par d’autres voies terrestres, ou encore directement par avion. D’après les données recueillies, la durée du voyage variait de quelques jours, pour les migrants qui avaient voyagé en avion, à deux ans, pour ceux qui avaient emprunté des itinéraires terrestres. Le délai entre l’arrivée en France et l’arrivée à Angers était également variable et pouvait atteindre plusieurs mois, avec des étapes dans d’autres villes.
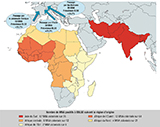 Agrandir l'image
Agrandir l'imageLa prévalence de la colonisation par des EBLSE était de 25,7% (36/139, IC95%: [18,4%-33,0%]). Aucune EPC et aucun ERG n’a été isolé des prélèvements réalisés. Les espèces bactériennes productrices de BLSE étaient Escherichia coli (N=31) et Klebsiella pneumoniae (N=5). Tous ces isolats étaient sensibles aux carbapénèmes, au cotrimoxazole et à l’amikacine. En revanche, 52,8% des isolats étaient résistants à la ciprofloxacine et 16,7% étaient résistants à la gentamicine. La prévalence de la colonisation par EBLSE ne variait pas de manière significative suivant la région d’origine : 32,3% (20/82) pour l’Afrique subsaharienne, 23,5% (4/21) pour l’Afrique du Nord et 33,3% (12/36) pour l’Asie du Sud.
L’analyse des isolats d’E. coli par électrophorèse en champ pulsé a permis d’identifier 4 clusters : 1 constitué de 3 isolats et 3 constitués de 2 isolats (figure 3). Ainsi au total, 29% (9/31) des E. coli producteurs de BLSE appartenaient à un cluster. De plus, à l’intérieur de 3 des 4 clusters, le pourcentage de similitude entre les isolats était >90%, ce qui était plutôt en faveur de transmissions récentes. Les itinéraires des migrants mineurs non accompagnés porteurs d’un isolat d’E. coli appartenant à 1 cluster sont présentés dans le tableau. Dans chacun des clusters 1, 2 et 4, les 2 ou 3 migrants mineurs non accompagnés venaient de pays différents, mais avaient consulté pour la première fois au CHU d’Angers aux mêmes dates ou à des dates très proches. Ils ont ainsi été probablement logés pendant la même période dans le même hôtel à Angers, comme c’est la règle pour ces migrants, depuis la date d’arrivée à Angers jusqu’à la date de la première consultation, soit généralement pendant deux à quatre semaines. Ce fort pourcentage de similitude entre les isolats d’un même cluster, la provenance de pays différents et un lieu d’hébergement commun au cours des quelques semaines précédant la date de leur prélèvement de selles sont des arguments en faveur de l’hypothèse d’une transmission après l’arrivée à Angers. Cette hypothèse est particulièrement vraisemblable pour les migrants AT6818WG55 et BG3142SG64 (tableau), pour lesquels les E. coli BLSE présentaient 100% d’homologie. Le cas du cluster 3 est plus complexe à analyser. Les deux migrants venaient de Guinée, avaient suivi des itinéraires différents et leurs dates de première consultation étaient distantes de plus de deux mois. En revanche, ils avaient séjourné à Paris au même moment (mars 2021), trois et six mois après leur départ de Guinée et deux et quatre mois avant leur arrivée à Angers. Même si nous n’avons aucune donnée concernant leur séjour à Paris et en particulier pas de dates exactes ni de lieux d’hébergement, il semble difficile d’exclure l’hypothèse d’une transmission entre les deux migrants pendant ce séjour.
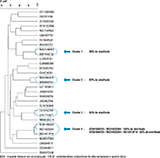 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageDiscussion-conclusion
À notre connaissance, nous avons présenté la première étude rapportant des données sur la colonisation par des EBLSE parmi les MNA arrivant en France, et l’une des rares études où près de 50% des migrants inclus provenaient d’Afrique de l’Ouest.
La colonisation par des bactéries multi-résistantes ou des BHRe n’est probablement pas le principal problème des réfugiés ou des demandeurs d’asile en général, et plus particulièrement des MNA. En effet, les migrants peuvent être atteints de maladies infectieuses comme la tuberculose, des hépatites virales et des parasitoses, en particulier la bilharziose 10. De plus, ils rencontrent des problèmes pratiques, par exemple pour le logement, pour les formalités administratives avec les autorités, également pour s’adapter aux différences culturelles entre le pays d’accueil et le pays d’origine. Enfin, ils peuvent connaître des problèmes psychologiques, comme un sentiment de frustration par rapport à leurs conditions de vie, ou d’incertitude par rapport à leur avenir 11. Cependant, même si elle ne représente pas le principal problème des migrants, la colonisation par des bactéries multi-résistantes, ou par des BHRe, doit être prise en considération car elle peut être la source de transmission en milieu hospitalier ou dans la communauté.
Nous avons rapporté une prévalence de colonisation par EBLSE de 25,7% chez les MNA au moment où les prélèvements de leurs selles avaient été effectués. Cette prévalence est voisine ou inférieure à celles qui ont été rapportées dans la plupart des autres études : 35% parmi les MNA arrivant à Francfort en Allemagne 12, 60% parmi les réfugiés dans une autre étude allemande 4 et 32,9% parmi les demandeurs d’asile et les réfugiés admis à l’hôpital universitaire d’Helsinki en Finlande 13. Cette différence pourrait s’expliquer en partie par la forte proportion de MNA venant d’Afrique (74,1%) dans notre étude, alors que dans les autres études la plupart des migrants venaient d’Asie ou du Moyen-Orient.
Il peut être intéressant de comparer la prévalence de la colonisation par EBLSE parmi les MNA avec la prévalence retrouvée chez les voyageurs. Au cours des 10 dernières années, de nombreuses études ont montré des proportions importantes de voyageurs colonisés par des bactéries multi-résistantes, en particulier des EBLSE, lors de leur retour en Europe. En 2010, Tham et coll. 14 ont montré que parmi 240 Suédois souffrant de diarrhée du voyageur à leur retour, 24% étaient colonisés par des EBLSE. Une étude réalisée auprès de volontaires suédois a montré la même proportion de voyageurs porteurs d’EBLSE. Cependant, cette prévalence peut varier fortement en fonction de la destination des voyageurs 14,15,16,17,18. Les prévalences les plus élevées sont retrouvées parmi les voyageurs revenant d’Asie et d’Inde. Une autre étude réalisée auprès d’étudiants en médecine au retour de stages à l’étranger a montré que 29,3% d’entre eux avaient acquis des EBLSE 19. La prévalence de la colonisation était plus élevée lorsqu’ils avaient séjourné au Viêt Nam ou dans le nord de l’Inde. Ainsi, d’après nos données, les MNA n’ont pas plus de risque d’être porteurs d’EBLSE à leur arrivée que les voyageurs revenant de pays à forte prévalence. Il semble donc que des recommandations complémentaires ne soient pas utiles pour prévenir les transmissions croisées d’EBLSE lors d’hospitalisation de ces migrants par rapport à ce qui est recommandé pour les voyageurs dans les douze mois suivant leur retour 20.
Un résultat important de notre étude est de suggérer la possibilité de transmission d’EBLSE entre les migrants dans les jours ou les quelques semaines qui suivent leur arrivée à destination. Les pourcentages de similitude élevés entre différents isolats sont en faveur de cette hypothèse. Le Conseil départemental du Maine-et-Loire favorise l’hébergement des migrants mineurs non accompagnés dans un même hôtel, en chambres doubles ou triples jusqu’à leur première consultation au CHU, et donc jusqu’au prélèvement de dépistage réalisé pendant la présente étude. Ainsi, il semble raisonnable de soutenir l’hypothèse d’une transmission des EBLSE pendant leur séjour dans cet hôtel. Des transmissions intrafamiliales d’EBLSE (Salmonella enterica et E. coli) ont été mises en évidence dans des familles françaises d’enfants adoptés en provenance d’un orphelinat de Bamako (Mali) 21. À ce sujet, l’une des limites de notre étude est la méthode de typage utilisée. Un séquençage des souches aurait permis de caractériser leur groupe phylogénétique, et ainsi de disposer de données d’épidémiologie moléculaire plus globales. Une autre limite à souligner est le caractère monocentrique de l’étude et son recrutement très localisé qui diminue les possibilités de généralisation des résultats.
Pour tenter de modérer les risques de transmission communautaire d’EBLSE entre les migrants, il pourrait être envisagé de reconsidérer leurs conditions d’hébergement au cours des premières semaines suivant leur arrivée. Cependant, il semble nécessaire de procéder avec une grande prudence. En effet, vivre en communauté dans un hôtel décent en chambre double ou triple présente probablement l’intérêt de rompre l’isolement des MNA. Des investigations complémentaires portant sur les conditions de logement apparaissent nécessaires pour trouver un juste équilibre entre la maîtrise de problèmes sanitaires, comme la transmission des bactéries multi-résistantes et de certaines maladies infectieuses, et l’importance de ne pas dégrader le bien-être des migrants.
Nos résultats présentent également l’intérêt d’éviter la stigmatisation des migrants mineurs non accompagnés concernant le risque pour eux d’être colonisés par des bactéries multi-résistantes. Aucun n’a été identifié comme porteur de BHRe dans notre étude, et nous avons constaté qu’ils ne présentaient pas plus de risque d’être porteurs d’EBLSE que les voyageurs au retour de pays à forte endémicité. Ces résultats pourraient donc permettre de rassurer les personnes (aidants, bénévoles…) qui sont en contact avec ces migrants et qui auraient des inquiétudes à ce sujet, d’autant plus que les risques de transmission, en dehors de situations bien particulières comme l’hospitalisation ou la cohabitation, semblent limités.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.




