Surveillance du chikungunya, de la dengue et des infections à virus Zika en France métropolitaine, 2016
// Chikungunya, dengue and Zika virus infection surveillance in mainland France, 2016
Résumé
Le moustique Aedes albopictus, vecteur des virus de la dengue, du chikungunya et du Zika, est présent en France métropolitaine depuis 2004. Il expose au risque de transmission autochtone de ces arboviroses du fait de l’introduction régulière des virus par des sujets infectés lors de séjours en zones de circulation de ces virus.
En métropole, la surveillance épidémiologique comprend deux dispositifs nationaux pérennes basés sur la déclaration obligatoire (DO) et sur un réseau de laboratoires, ainsi qu’un dispositif local de surveillance renforcée dans les départements où Ae. albopictus est implanté pendant sa période d’activité, estimée du 1er mai au 30 novembre.
En 2016, en France métropolitaine, 34 cas de chikungunya, 184 cas de dengue et 781 cas d’infection à virus Zika ont fait l’objet d’une DO. Le réseau de laboratoires a identifié 415 personnes ayant au moins un résultat biologique positif pour le chikungunya, 723 pour la dengue et 1 060 pour une infection à virus Zika. Du 1er mai au 30 novembre, 18 cas de chikungunya, 167 cas de dengue, 453 cas d’infection à virus Zika, 1 co-infection dengue-Zika et 9 cas de flavivirus ont été confirmés dans les 30 départements où Ae. albopictus était implanté. Tous étaient importés, à l’exception de 3 cas autochtones d’infection à virus Zika, contaminés par voie sexuelle.
Les résultats de la surveillance de ces maladies en métropole reflétaient la situation épidémiologique dans les zones de provenance des voyageurs. L’épidémie d’infection à virus Zika dans les territoires français d’Amérique (TFA) a eu un impact majeur sur le nombre de cas importés et, plus généralement, sur la surveillance en 2016. Le risque de transmission autochtone est toujours présent en métropole. Il est conditionné par l’extension d’Ae. albopictus et par la situation épidémiologique internationale. Il est nécessaire d’informer les voyageurs se rendant ou revenant des zones à risque ainsi que les professionnels de santé pour qu’ils relaient les consignes de prévention et participent à la surveillance.
Abstract
Aedes albopictus, the vector of dengue, chikungunya and Zika viruses, has been established in mainland France since 2004, introducing the risk of autochthonous transmission of these vector-borne infections due to the repeated introduction of the viruses by infected travelers returning from endemic regions.
In mainland France, epidemiological surveillance is based at the national level on mandatory notification (MN) and a network of laboratories. At the regional level, enhanced surveillance is implemented in the districts where the mosquito is established, during its period of activity from 1 May to 30 November.
In 2016, in mainland France, 34 chikungunya cases, 184 dengue cases and 781 Zika virus infection cases were notified. The laboratory network identified 415 persons with at least one positive biological result for chikungunya, 723 for dengue and 1,060 for Zika virus infection. From 1 May to 30 November, 18 chikungunya cases, 167 dengue cases, 453 Zika virus infection cases, 1 dengue-Zika coinfection case and 9 flavivirus cases were confirmed in the 30 districts where the vector was established. All cases were imported, except 3 autochthonous Zika virus infection cases due to sexual transmission.
These surveillance data in mainland France reflected the epidemiological situation in the areas where travelers come from. The Zika virus epidemic in the French territories of America had a major impact on the number of imported cases, and more generally on the surveillance in 2016. The risk of autochthonous transmission is still present in mainland France. It is determined by the geographical expansion of Ae. albopictus and the international epidemiological situation of arboviruses. It is therefore necessary to keep informing travelers to and from risk areas, and healthcare professionals, in order to disseminate prevention messages and to involve them in the surveillance system.
Introduction
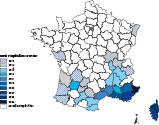
L’implantation du moustique Aedes albopictus, ou moustique tigre, vecteur des virus de la dengue et du chikungunya, et vecteur potentiel du virus Zika 1, s’étend progressivement en France métropolitaine. Détecté pour la 1ère fois en 2004 dans le département des Alpes-Maritimes, il était implanté et actif en 2016 dans 30 départements (1) 2 (figure 1). Sa présence expose au risque de transmission autochtone de ces arboviroses à la faveur de l’introduction des virus par des sujets infectés dans les zones de circulation de ces virus. Des épisodes de transmission autochtone se sont déjà produits en France métropolitaine, avec des foyers de dengue en 2010, 2013, 2014 et 2015 et de chikungunya en 2010 et 2014 3,4,5,6,7,8, et plus généralement en Europe 9,10. Depuis 2006, un plan national « anti-dissémination du chikungunya et de la dengue en métropole 2 » est mis en œuvre chaque année. L’épidémie d’infection à virus Zika dans la zone Amérique a entrainé l’inclusion en 2016 de cette maladie dans le plan. Le dispositif associe un système de surveillance humaine et entomologique à des mesures de prévention et de contrôle.
 Agrandir l'image
Agrandir l'imageCet article présente les résultats de la surveillance du chikungunya, de la dengue et des infections à virus Zika en France métropolitaine en 2016.
Surveillance épidémiologique humaine
La surveillance épidémiologique a pour objectifs de détecter précocement les cas importés et autochtones de dengue, de chikungunya et d’infection à virus Zika afin de déclencher les mesures de lutte anti-vectorielle (LAV) appropriées autour de ces cas et de décrire les tendances nationales et régionales de ces infections. Ces données permettent d’évaluer le risque de transmission autochtone et d’orienter les politiques de prévention et de lutte contre ces arboviroses. Les modalités de la surveillance sont adaptées aux cinq niveaux de risque décrits dans le plan national (tableau 1) et basées sur une définition de cas suspects, confirmés, importés et autochtones (tableau 2). Les niveaux de risque sont définis par département.
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageLe système de surveillance en France métropolitaine comprend :
–deux dispositifs nationaux pérennes :
–la déclaration obligatoire (DO) des cas confirmés : elle s’applique tout au long de l’année. Des données sociodémographiques, cliniques (signes, date de début des signes), biologiques et épidémiologiques (voyage hors métropole, date de retour en métropole) permettent de décrire les cas, leur période de séjour en zone de circulation virale et leur période de virémie (comprise entre deux jours avant le début des signes cliniques et jusqu’à sept jours après) ;
–un réseau national de laboratoires volontaires : il transmet à Santé publique France les résultats des diagnostics biologiques du chikungunya, de la dengue et des infections à virus Zika. Il est composé de cinq laboratoires : le Centre national de référence (CNR) des arbovirus, le laboratoire de bactériologie-virologie du Centre hospitalier universitaire (CHU) Avicenne (Bobigny), le laboratoire de virologie du CHU de la Timone (Marseille) et les laboratoires privés Biomnis et Cerba. Les prélèvements de patients ambulatoires sont majoritairement traités par les laboratoires Biomnis et Cerba, qui couvrent tout le territoire métropolitain. En complément, des laboratoires d’autres CHU participent à ce réseau en communiquant leurs résultats positifs pendant la période d’activité d’Ae. albopictus (surveillance renforcée, cf. infra) ;
–un dispositif local de surveillance renforcée, appliqué depuis 2006 dans les départements où Ae. albopictus est implanté, pendant sa période d’activité, du 1er mai au 30 novembre. Ce dispositif est basé sur le signalement accéléré des cas aux Agences régionales de santé (ARS).
En l’absence de transmission autochtone (niveau 1 du plan), le signalement concerne les cas importés dès la suspicion et les cas autochtones confirmés (tableau 2). En présence d’une transmission autochtone (niveau 2 et plus), le signalement dès la suspicion s’applique aussi aux cas autochtones.
En complément, l’analyse quotidienne des données des laboratoires Biomnis et Cerba dans ces départements permet l’identification des cas qui n’ont pas été déclarés par le dispositif de signalement accéléré.
Le signalement d’un cas entraîne immédiatement des investigations épidémiologiques pour déterminer la période d’exposition et de virémie ainsi que les lieux de séjour et déplacements pendant cette période. Des investigations entomologiques et des actions de LAV appropriées sont menées, avec destruction des gîtes larvaires et, si nécessaire, traitements adulticides ou larvicides ciblés dans un périmètre de 150 à 200 mètres autour des lieux fréquentés par les cas pendant la période de virémie. En présence d’un cas autochtone confirmé, ces actions sont couplées à une recherche active du cas primaire et d’autres cas dans l’entourage du patient. Les actions suivantes sont notamment réalisées : une enquête en porte-à-porte autour du lieu de résidence du cas et des lieux visités pendant sa période de virémie, une information et une sensibilisation des professionnels de santé. Des actions de LAV autour des lieux fréquentés par le cas durant la période d’exposition y sont associées.
Il est à noter qu’un cas peut être identifié par les trois dispositifs : le dispositif accéléré, le réseau de laboratoire et la DO. Le plus souvent, les cas ayant fait l’objet d’un signalement dans le cadre du dispositif accéléré ne font pas en plus l’objet d’une DO.
En raison des complications liées aux infections à virus Zika, la surveillance épidémiologique était complétée par un suivi spécifique des femmes enceintes et des formes graves (voir encadrés 1 et 2). Pour les infections à virus Zika, l’investigation épidémiologique portait aussi sur le risque de transmission sexuelle.
Résultats
Surveillance par la déclaration obligatoire
En 2016, 34 cas de chikungunya, 184 cas de dengue, tous importés, et 781 cas d’infection à virus Zika, dont 12 cas autochtones par transmission sexuelle, ont été déclarés en métropole par le dispositif de la DO.
Pour les 34 cas confirmés de chikungunya, l’âge médian était de 47 ans (extrêmes : 21-78), le sex-ratio H/F était de 1,1. Deux cas ont été hospitalisés (6%). Aucun décès n’a été enregistré. La plupart des cas revenaient d’Amérique latine ou des Caraïbes (18 cas, soit 53%) et d’Asie (13 cas, soit 38%). Les cas ont été notifiés tout au long de l’année.
Pour les 184 cas confirmés de dengue, l’âge médian était de 34 ans (extrêmes : 4-82), le sex-ratio H/F était de 0,9. Soixante-un cas ont été hospitalisés (38%). Aucun décès n’a été enregistré. La plupart des cas revenaient d’Asie (98 cas, soit 54%) et d’Amérique latine ou des Caraïbes (42 cas, soit 23%). Les cas ont été notifiés tout au long de l’année, avec un pic de signalement en août.
Pour les 781 cas confirmés d’infection à virus Zika, l’âge médian était de 41 ans (extrêmes : 0-84), le sex-ratio H/F était de 0,7. Trente-six cas ont été hospitalisés (5%). Un décès a été enregistré. La plupart des cas (80%) revenaient des territoires français d’Amérique (TFA). Le nombre de cas notifiés était important de février à septembre, avec un pic de signalement en avril et en juillet.
La répartition des cas par critères de notification est donnée dans le tableau 3.
 Agrandir l'image
Agrandir l'imageSurveillance par le réseau national de laboratoires volontaires
En 2016, le réseau de laboratoires a identifié 415 personnes ayant au moins un résultat biologique positif pour le chikungunya, 723 pour la dengue et 1 060 pour une infection à virus Zika. Parmi ces personnes, 90 avaient une sérologie positive à la fois pour la dengue et pour une infection à virus Zika ne permettant pas de différencier ces deux flavivirus (possibles réactions croisées).
Pour le chikungunya, l’âge médian était de 41 ans (extrêmes : 0-86) et le sex-ratio H/F de 0,8. Pour la dengue, l’âge médian était de 43 ans (extrêmes : 1-80) et le sex-ratio H/F de 0,9. Pour les infections à virus Zika, l’âge médian était de 41 ans (extrêmes : 0-83) et le sex-ratio H/F de 0,6. Les résultats ont été obtenus tout au long de l’année pour le chikungunya et la dengue, principalement entre mai et septembre pour les infections à virus Zika.
Surveillance renforcée dans les départements d’implantation du moustique Ae. albopictus
Du 1er mai au 30 novembre 2016, 1 311 signalements ont été investigués. Parmi eux, 648 cas (49%) ont été confirmés 11 :
–18 cas importés de chikungunya ;
–167 cas importés de dengue ;
–450 cas importés d’infection à virus Zika ;
–1 cas importé de co-infection dengue/Zika ;
–9 cas importés de flavivirus (résultats sérologiques ne permettant pas de distinguer la dengue d’une infection à virus Zika) ;
–3 cas autochtones d’infection à virus Zika par transmission sexuelle.
Les signalements provenaient pour 64% de la surveillance accélérée, 30% de l’analyse des données des laboratoires Biomnis et Cerba et 6% de la DO.
Parmi les 1 311 signalements, 1 025 cas avaient le statut importé et 278 celui d’autochtone. Pour 8 signalements, le caractère importé ou autochtone n’était pas documenté.
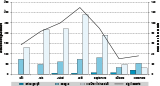
La grande majorité des cas importés d’infection à virus Zika a été signalée de juin à septembre (figure 2). La baisse du nombre de cas à partir d’octobre correspondait à la fin de l’épidémie dans les TFA. Pour la dengue, le nombre de cas confirmés était constant tout au long de la période de surveillance. Les 2/3 des cas de chikungunya ont été signalés en octobre-novembre.
 Agrandir l'image
Agrandir l'imageLa répartition des signalements et des cas confirmés par département est donnée dans le tableau 4.
 Agrandir l'image
Agrandir l'imageParmi les cas importés d’infection à virus Zika, 90% provenaient des TFA. Les zones les plus souvent fréquentées par les cas importés de dengue étaient l’Asie du Sud-Est (51%), la Polynésie française (16%), l’Amérique latine et les Caraïbes (16%), et l’Afrique (13%). Les 2/3 des cas importés de chikungunya avaient séjourné en Asie du Sud-Est, essentiellement en Inde.
L’âge médian des cas confirmés de chikungunya, de dengue et d’infection à virus Zika était respectivement de 47 ans (extrêmes : 22-69), 39 ans (extrêmes : 1-79) et 38 ans (extrêmes : 2-82). Le sex-ratio H/F des cas confirmés était respectivement de 0,6 (7/11), 1,0 (85/82) et 0,7 (188/265).
Les cas confirmés provenaient pour 43% d’entre eux de la surveillance accélérée, pour 45% de l’analyse des données des laboratoires Biomnis et Cerba et pour 12% de la DO.
Au total, 63% (645/1025) des signalements de cas importés et 1% (3/278) des signalements de cas autochtones ont été confirmés.
Le nombre de cas importés confirmés présents dans un département colonisé par Ae. albopictus pendant la période de virémie était de 567 (88%).
Toutes sources de signalement confondues, le délai médian entre la date de début des signes et le signalement à l’ARS était de 8 jours. Il était de 5 jours pour la surveillance accélérée, 15 jours suite à l’analyse des données des laboratoires Biomnis et Cerba et 8 jours pour la DO. Le délai médian entre le début des signes et le 1er prélèvement était de 5 jours. Le délai médian entre le signalement par la surveillance accélérée et la confirmation du diagnostic était de 5 jours.
Il est à noter que 80 des 109 cas suspects signalés avec des IgM anti-chikungunya isolées se sont avérés être des faux positifs : absence de confirmation par le CNR des arbovirus ou de séroconversion sur un 2e prélèvement.
Des prospections entomologiques ont été réalisées pour 703 cas (69% des 1 025 cas importés, suspects ou confirmés). Elles ont donné lieu à des traitements adulticides pour 121 cas (17%).
Discussion
Les arboviroses, en expansion dans le monde, sont responsables d’une part importante des infections émergentes. Les cas importés de chikungunya, de dengue et d’infection à virus Zika identifiés en métropole reflètent la situation épidémiologique dans les zones à risque et le flux des voyageurs.
En 2016, un nombre important de cas d’infection à virus Zika importés a été déclaré en France métropolitaine, conséquence directe de l’épidémie dans les TFA 12. La dynamique des cas déclarés en métropole était concomitante avec celle de cette épidémie. Pour rappel, l’année 2014 avait aussi été marquée par l’augmentation importante du nombre de cas de chikungunya importés, du fait de l’épidémie sévissant dans les TFA 13,14,15. En France métropolitaine, sur l’ensemble de l’année 2016, si aucun cas autochtone par transmission vectorielle n’a été identifié, 12 cas autochtones par transmission sexuelle d’infection à virus Zika ont été décrits 16,17.
Les nombres de cas de dengue et de chikungunya rapportés par les différents dispositifs de surveillance, proches de ceux identifiés en 2015 18, reflétaient l’absence d’épidémie de dengue ou de chikungunya dans les départements français d’outremer. Les zones d’importation les plus fréquemment retrouvées étaient l’Asie, l’Amérique latine et les Caraïbes.
Si l’Ae. Albopictus présent en métropole a montré à plusieurs reprises sa capacité à transmettre les virus de la dengue et du chikungunya, seule sa compétence vectorielle a été établie pour le virus Zika, compétence qui semble plus faible que celle d’Aedes aegypti 19.
Le nombre de DO de chikungunya et de dengue reçues était largement inférieur au nombre de cas identifiés par le réseau de laboratoires, indiquant une faible exhaustivité de la DO. Cette situation avait également été observée en 2014 et 2015 15,18. L’écart plus important retrouvé pour le chikungunya (tableau 3) s’expliquait en partie par une surestimation des cas identifiés par les laboratoires en raison de faux positifs parmi les IgM isolées. Pendant la surveillance renforcée, 73% des cas suspects signalés avec IgM anti-chikungunya isolées se sont avérés être des faux positifs. Une étude est actuellement en cours pour quantifier l’exhaustivité de la DO dengue et chikungunya par rapport aux données du réseau de laboratoires et pour décrire les caractéristiques pouvant influencer cette exhaustivité. L’exhaustivité de la DO des infections à virus Zika semblait meilleure, probablement liée à la forte sensibilisation des professionnels de santé à ce sujet en 2016 (tableau 3). Malgré ces limites, la DO fournit des informations cliniques, biologiques et épidémiologiques non disponibles dans les données du réseau de laboratoires et permet une meilleure analyse du risque de transmission autochtone en métropole. C’est à ce titre un outil de surveillance important pour le contrôle des arboviroses, dont la place pourrait être développée, notamment dans la perspective de l’extension de l’implantation du vecteur Ae. albopictus en métropole. Dans ce contexte, il serait souhaitable d’obtenir une meilleure adhésion des professionnels de santé à la DO.
La moitié des signalements reçus dans le cadre de la surveillance renforcée ont été confirmés. Près de 70% des cas suspects importés qui étaient potentiellement virémiques en département d’implantation d’Ae. albopictus ont fait l’objet d’investigations des opérateurs publics de démoustication afin d’éviter la survenue de cycles de transmission autochtones. Cent-vingt-et-une situations à risque ont été identifiées (cas importé confirmé et présence de moustiques adultes autour du cas) ; néanmoins, aucun cycle de transmission vectorielle autochtone n’a été détecté.
Comme les années précédentes, l’analyse des données des laboratoires Biomnis et Cerba s’est avérée essentielle et a permis l’identification de 45% des cas confirmés. Mais les délais de mise en place des mesures de LAV pour ces cas sont plus importants et augmentent le risque d’une transmission autochtone des virus. Il est important de réduire la part des cas identifiés par ce système en encourageant le signalement volontaire des cas par les professionnels de santé.
Le sex-ratio H/F était plus faible pour les cas d’infection à virus Zika que pour les cas de dengue et de chikungunya. Un recours plus important des femmes au diagnostic biologique du virus Zika, lié aux risques de complications pour les femmes enceintes (embryofœtopathies), pourrait être une explication. Néanmoins, l’impact de la transmission sexuelle homme-femme du virus Zika ne peut pas être totalement exclu 20.
Ce système de surveillance complexe, mis en place en métropole depuis 2006, permet grâce à ses différentes composantes de répondre à plusieurs objectifs opérationnels de surveillance du chikungunya, de la dengue et des infections à virus Zika. Dans un souci de durabilité et d’efficience, il doit néanmoins évoluer au fur et à mesure de l’extension du vecteur et du risque de transmission locale.
L’émergence des infections à virus Zika a complexifié le dispositif en raison de leurs spécificités. Elles se démarquent du chikungunya et de la dengue sur deux points principaux : une transmission sexuelle avérée en cas de rapports non protégés avec une personne qui a contracté une infection à virus Zika et une population particulièrement à risque, les femmes enceintes, avec un risque de malformations congénitales en cas d’infection pendant la grossesse.
Si les infections à virus Zika ont été au cœur des préoccupations en 2016, il ne faut pas oublier pour autant les risques d’émergence du chikungunya et de la dengue en métropole. Depuis 2010, huit épisodes de transmission autochtone ont été enregistrés dans le sud de la France, le dernier en date étant le foyer de dengue investigué en 2015 à Nîmes 8.
L’information du public sur ces maladies, la lutte contre les moustiques vecteurs et les mesures de protection individuelles et collectives sont primordiales. D’autant que le dispositif de surveillance ne peut être totalement exhaustif et que 20 à 70% de ces arboviroses peuvent être asymptomatiques (au moins 50% pour le Zika) 21,22. Le rôle des voyageurs, en partance ou de retour de zones à risque, dans la transmission nécessite une sensibilisation des professionnels du tourisme. Parallèlement il faut, dans les départements où Ae. albopictus est implanté, que toute la communauté se sente impliquée dans la lutte contre ce vecteur au sein de son milieu de vie.
Enfin, les professionnels de santé sont au cœur du dispositif de surveillance épidémiologique. Leur adhésion est essentielle. En période d’activité du vecteur, le signalement volontaire des cas par les médecins et les laboratoires permet d’engager rapidement des investigations entomologiques et des actions de LAV appropriées, limitant ainsi le risque de transmission autochtone. Leur participation est conditionnée par un dispositif de surveillance adapté à la situation et par une sensibilisation de qualité.
Conclusion
En 2016, l’épidémie d’infection à virus Zika dans les TFA a eu un impact important sur la métropole. La grande majorité des cas identifiés dans le cadre de la surveillance était des cas d’infection à virus Zika.
Tous les cas de chikungunya, de dengue et d’infection à virus Zika détectés par la surveillance étaient importés, à l’exception de 12 cas autochtones d’infection à virus Zika par transmission sexuelle.
Les différentes composantes de la surveillance ont répondu aux différents objectifs fixés, même si des pistes d’amélioration ont été identifiées. La surveillance renforcée a permis, comme chaque année, de mener des investigations entomologiques et des actions de LAV autour des situations identifiées comme à risque (cas importés potentiellement virémiques, suspects ou confirmés, et présence du vecteur), réduisant ainsi le risque d’apparition d’une chaine de transmission autochtone.
Le nombre croissant d’échanges avec les pays de circulation de ces virus, l’extension d’Ae. albopictus en métropole et la présence d’une population susceptible du fait d’une immunité inexistante incitent à renforcer la sensibilisation du public et des voyageurs se rendant ou revenant de zones de circulation de ces virus. Cette sensibilisation doit s’orienter sur les maladies transmises par les moustiques, la lutte contre les moustiques vecteurs et les mesures de protection individuelles et collectives. Les professionnels de santé jouent un rôle essentiel dans cette sensibilisation et dans la surveillance épidémiologique.
Surveillance en France métropolitaine des femmes enceintes infectées par le virus Zika
En février 2016, Santé publique France a mis en place, en collaboration avec la fédération des Centres pluridisciplinaires de diagnostic prénatal, une surveillance des issues de grossesse chez les femmes enceintes infectées par le virus Zika, résidant ou étant prises en charge en métropole. Cette surveillance visait à documenter les complications fœtales des infections à virus Zika, alors que de nombreuses inconnues entouraient la responsabilité de ce virus dans la survenue de microcéphalies et autres complications neurologiques fœtales. Il complétait le dispositif mis en place dans les Territoires français d’Amérique (TFA).
En 2016, 63 grossesses chez des femmes infectées par le virus Zika ont été recensées en métropole. Pour 62 d’entre elles, l’infection avait été contractée dans une zone où sévissait une épidémie d’infection à virus Zika, notamment dans les TFA (44, soit 70% des cas). Une femme a été infectée en métropole par transmission sexuelle.
L’issue de grossesse était connue pour 24 grossesses : 18 naissances d’enfants vivant sans anomalie possiblement en lien avec l’infection à virus Zika ont été notifiées ainsi que 2 avortements spontanés, 1 interruption volontaire de grossesse à 11 semaines d’aménorrhée et 3 interruptions médicales de grossesse pour fœtopathie possiblement liée à une infection à virus Zika. Cinq femmes, parmi lesquelles deux résidant à l’étranger, ont été perdues de vue. La surveillance et la collecte de données sont en cours pour les autres patientes et feront l’objet d’une actualisation.
Surveillance en France métropolitaine des complications neurologiques dues à une infection à virus Zika
Les complications embryofœtales ne sont pas les seules complications décrites en lien avec le virus Zika. Il existe aussi des présentations cliniques neurologiques en cas d’infection après l’enfance, principalement des syndromes de Guillain-Barré.
En janvier 2016, une surveillance des manifestations neurologiques en lien avec le virus Zika a été mise en place via la déclaration obligatoire (DO) des infections à virus Zika et le CNR. En effet, la présentation clinique, et notamment les formes neurologiques, font partie des éléments recueillis dans la fiche de demande d’examen diagnostique du CNR et notés par les déclarants dans la fiche de DO.
En 2016, 5 cas ayant présenté des formes neurologiques graves en lien avec le virus Zika ont été diagnostiqués en France métropolitaine. Il s’agissait de personnes ayant présenté une infection par le virus Zika au retour de zone de circulation virale se manifestant par une encéphalite 23, une méningite ou un syndrome de Guillain Barré (pour 3 cas).
Groupe d’investigation
Caroline Six, Guillaume Heuzé, Jeanne Rizzi, Samer Aboukaïs, Thérèse Lebaillif, Isabelle Teruel, Françoise Peloux-Petiot, Karine Lopez, Sylvie Dunaud, Anne Decoppet, Lucette Pigaglio, Michelle Auzet-Caillaud, Monique Travanut, Muriel Andrieu-Semmel, Annie Macarry, Roselyne Mariani, Cécile Forgeot, Jan Julie, Isabelle Poujol, Delphine Casamatta, Vincent Ronin, Cyril Rousseau, Cécile Durand, Tiphanie Succo, Jeanine Stoll, Sophie Raguet, Louis Frelon, Véronique Servas, Aurélie Fischer, Raoul Nawabzad, Bruno Hubert, Anne-Hélène Liébert, Virginie Douet, Elisabeth Nuiaouet, Gilda Grard, Mathilde Galla.




