Diabète gestationnel en France en 2012 : dépistage, prévalence et modalités de prise en charge pendant la grossesse
// Gestational diabetes in France in 2012: screening, prevalence and treatment modalities during pregnancy
Résumé
Objectifs –
1) Estimer la prévalence et la fréquence du dépistage du diabète gestationnel (DG) en 2012 en France, en population générale et chez les femmes à risque, après la publication fin 2010 de nouvelles recommandations de dépistage ciblé sur facteurs de risque, 2) décrire la prise en charge pendant la grossesse des femmes avec DG et les caractéristiques de leur enfant à la naissance.
Méthodes –
L’étude a porté sur 3 353 dyades mère-enfant issues d’un échantillon aléatoire d’enfants nés en 2012 dans 136 maternités tirées au sort en France métropolitaine dans le cadre de l’étude Épifane (Épidémiologie en France de l’alimentation et de l’état nutritionnel des enfants pendant leur première année de vie). Les caractéristiques sociodémographiques, le diagnostic et le dépistage du DG, ainsi que le poids et la taille avant grossesse ont été renseignés par la mère. Les sages-femmes ont relevé dans le dossier médical les antécédents et les données médicales relatives à la grossesse, à l’accouchement et au nouveau-né. Les analyses ont été pondérées selon le plan de sondage et la non-réponse.
Résultats –
En France métropolitaine, en 2012, selon notre étude, la prévalence du DG était de 8,0% [7,0-9,0]. 76,1% des femmes déclaraient avoir été dépistées par un test d’hyperglycémie provoquée par voie orale, alors que la proportion de femmes présentant au moins un des trois facteurs de risque suivants - âge ≥35 ans, surpoids/obésité ou antécédents de diabète gestationnel - n’était que de 41,8%. Malgré la proportion élevée de femmes dépistées, 18,3% des femmes âgées de 35 ans ou plus, 15,3% des femmes en surpoids, 9,8% des femmes obèses et 2,8% des femmes ayant des antécédents de DG déclaraient ne pas avoir été dépistées. Parmi les femmes avec DG, 86,5% déclaraient avoir eu recours à un endocrinologue ou à un(e) diététicien(ne), 48,8% qu’elles avaient reçu des recommandations d’activité physique, 81,8% qu’elles avaient utilisé un lecteur glycémique et 26,9% étaient traitées par insuline. Pendant la grossesse, les femmes avec un diagnostic de DG bénéficiaient de davantage de consultations prénatales et étaient plus fréquemment hospitalisées (27,1% vs. 14,0% pour les autres). L’accouchement était moins fréquemment spontané et plus souvent par césarienne chez les femmes avec DG que chez les autres. Les nouveau-nés de mère présentant un DG apparaissaient plus souvent macrosomes (9,4%) que ceux de mères dépistées mais non diagnostiquées (7,6%) et que ceux des femmes non dépistées (5,9%), bien que cette différence ne soit pas statistiquement significative (p=0,15).
Conclusions –
Le diabète gestationnel concernait en 2012 une proportion notable des grossesses (8%). Le taux de dépistage était élevé (76,1%). Les pratiques de dépistage pourraient néanmoins être améliorées chez les femmes âgées de 35 ans et plus, en surpoids ou obèses, ou ayant des antécédents de DG.
Abstract
Objectives –
1) To estimate the prevalence and frequency of screening for gestational diabetes (GDM) in 2012 in France in the general population and among women at risk, after the publication of new French recommendations in 2010 endorsing risk factor based screening; 2) to describe care during pregnancy in women with GDM and the characteristics of their child at birth.
Methods –
The study included 3,353 mother-infant pairs from a random sample of children born in 2012 in 136 randomly selected maternity wards in metropolitan France as part of the Epifane Study (Epidemiology of Feeding Practices and Nutritional Status of Infants During their First Year of Life Study). The socio-demographic characteristics, diagnosis and screening for GDM, as well as maternal weight and height before pregnancy, were filled in by the mother. Based on the medical records, midwives noted the medical history, data related to pregnancy, to childbirth and to the newborn. All analyzes were weighted based on a sample design plan and non-response.
Results –
Our study shows that in metropolitan France in 2012, GDM prevalence was 8.0% [7.0-9.0]. 76.1% of women reported to have been screened by an oral glucose tolerance test, while the proportion of women with at least one of the three risk factors was only 41.8%: age ≥35 years, overweight / obesity or history of gestational diabetes. Despite the high proportion of women screened, 18.3% of women aged 35 or older, 15.3% of overweight women, 9.8% of obese women, and 2.8% of women with a history of GDM reported they had not been screened. Among women with GDM, 86.5% of them reported having consulted an endocrinologist or a dietician, 48.8% that they had received physical activity recommendations, 81.8% said they had used a blood glucose monitor, and 26.9% were treated with insulin. During pregnancy, women with a diagnosis of GDM benefited from more antenatal visits and were more frequently hospitalized (27.1% vs. 14.0% for others). The delivery was less frequently spontaneous and more often by cesarean section in women with GDM than in others. Newborns of GDM mothers were more often macrosomic (9.4%) than babies born to screened mothers without GDM diagnosis (7.6%) and to mothers who had not been screened (5.9%), although this difference was not statistically significant (p=0.15).
Conclusions –
In 2012, gestational diabetes was diagnosed in a significant proportion of pregnancies (8%). The screening rate was high (76.1%). Screening practices could still be improved among women aged 35 and older, overweight or obese, or with a history of gestational diabetes.
Introduction
Le diabète gestationnel (DG) est un trouble de la tolérance glucidique conduisant à une hyperglycémie de sévérité variable, débutant ou diagnostiqué pour la première fois pendant la grossesse 1. Chez la mère, le DG est associé pendant la grossesse à un risque accru d’hypertension artérielle gravidique, de pré-éclampsie et de césarienne 1. La principale complication pour l’enfant est la macrosomie (poids de naissance >4 kg), qui s’accompagne d’un risque accru de dystocie des épaules à la naissance 2. À plus long terme, le DG est associé à un risque élevé pour la mère de développer ultérieurement un diabète de type 2 3 et, potentiellement, à un risque de surpoids/obésité et de diabète de type 2 pour les enfants 4.
En 2004, le registre Audipog 5, renseigné par des maternités volontaires publiques et privées provenant de toutes les régions de France, avait rapporté une prévalence du DG de 3,8%. Par comparaison, en 2010, l’Enquête nationale périnatale (ENP) avait estimé, pour la première fois au niveau national, la prévalence du DG à 7,2% à partir des données du dossier médical de la maternité 6. L’interprétation des évolutions de prévalence est limitée car celles-ci sont très sensibles aux pratiques de dépistage, aux différences méthodologiques entre les études et aux changements de recommandations. Ces résultats suggèrent néanmoins une possible tendance à l’augmentation, en accord avec la littérature qui pointe un phénomène mondial lié au développement, depuis plusieurs décennies, des habitudes de vie obésogènes. Ainsi, une étude menée sur 19 États américains suggère une augmentation relative du DG de 56% entre 2000 et 2010, la prévalence passant de 3,7% à 5,8%, avec de larges variations géographiques et ethniques 7. A contrario, une étude menée dans un hôpital de Seine-Saint-Denis, entre 2002 et 2010, c’est-à-dire avant le changement des recommandations françaises, a montré une stabilité de la prévalence du DG, alors que le mode de dépistage utilisé restait le même sur l’ensemble de la période 8.
En 2010, l’International Association of Diabetes and Pregnancy Study Groups (IADPSG) a proposé, suite aux résultats de l’étude HAPO 9, de nouveaux seuils glycémiques, basés sur l’utilisation d’un test d’hyperglycémie par voie orale (HGPO) au moyen d’une charge de 75g de glucose 10. Une conséquence attendue au niveau international de la mise en place des recommandations de l’IADPSG était un doublement, voire un triplement, de la prévalence du DG 11. La même année, la Société francophone du diabète (SFD) et le Collège national des gynécologues et obstétriciens français (CNGOF) ont publié conjointement des recommandations (voir encadré) préconisant l’utilisation des seuils glycémiques de l’IADPSG, mais dans le cadre d’un dépistage ciblé sur facteurs de risque. D’autres facteurs parfois associés au DG tels que l’origine ethnique, le niveau socioéconomique ou le syndrome des ovaires polykystiques 1 n’ont pas, au vu de la littérature, été retenus.
Les objectifs de cette étude étaient 1) d’estimer la prévalence et la fréquence du dépistage du DG en population générale en 2012 et chez les femmes à risque, après la publication fin 2010 de nouvelles recommandations françaises, 2) de décrire la prise en charge pendant la grossesse des femmes avec DG et les caractéristiques de leur enfant à la naissance.
Recommandations de la Société francophone du diabète (SFD) et du Collège national des gynécologues et obstétriciens français (CNGOF) pour le dépistage du diabète gestationnel (décembre 2010) 1
Le dépistage du diabète gestationnel est recommandé en présence d’au moins un des critères suivants : âge maternel ≥35 ans, IMC ≥25 kg/m2, antécédents de diabète chez les apparentés au 1er degré, antécédents personnels de diabète gestationnel ou d’enfant macrosome.
Au premier trimestre, en présence de facteur de risque, il est recommandé de réaliser une glycémie à jeun. En début de grossesse, il est recommandé de porter le diagnostic de diabète de type 2 sur une glycémie à jeun ≥1,26 g/l (7 mmol/l), et ≥0,92 g/l (5,1 mmol/l) pour le diagnostic de diabète gestationnel.
Entre 24 et 28 semaines d’aménorrhée (SA), le test de l’hyperglycémie par voie orale avec 75 g de glucose et mesure des glycémies à 0,1 et 2 heures est recommandé pour le diagnostic du diabète gestationnel chez les femmes avec facteur de risque. Les critères diagnostiques entre 24 et 28 SA : glycémie à jeun ≥0,92 g/l (5,1 mmol/l) et/ou glycémie 1 heure après une charge orale de 75 g de glucose ≥1,80 g/l (10,0 mmol/l) et/ou glycémie 2 heures après la charge ≥1,53 g/l (8,5 mmol/l).
Chez les femmes ayant des facteurs de risque qui n’ont pas eu de dépistage du diabète gestationnel, celui-ci peut être fait au 3e trimestre, au minimum par une glycémie à jeun.
Matériel et méthodes
Collecte des données
L’étude Épifane (Épidémiologie en France de l’alimentation et de l’état nutritionnel des enfants pendant leur première année de vie) a porté sur un échantillon aléatoire de mères et d’enfants nés au premier trimestre 2012 dans 136 maternités tirées au sort en France métropolitaine. Le plan de sondage a été détaillé précédemment 12,13. Pour être incluses, les mères devaient être majeures, résider en France métropolitaine et maîtriser suffisamment le français. Les enfants devaient être nés à 33 semaines d’aménorrhée (SA) ou plus et ne pas présenter une pathologie lourde ayant nécessité une chirurgie, une prise en charge particulière ou un transfert.
À la maternité, un auto-questionnaire était rempli par la mère tandis que la sage-femme complétait un questionnaire médical à partir du dossier médical. Des questionnaires étaient ensuite adressés à la mère à 1 mois, 4 mois, 8 mois et 12 mois après l’accouchement.
Les autres données collectées auprès de la mère incluaient des facteurs sociodémographiques, tels le niveau d’études de la mère, son pays de naissance, sa profession et catégorie socioprofessionnelle (PCS), sa corpulence avant et en fin de grossesse (d’après l’indice de masse corporelle (IMC), sur la base du poids et de la taille déclarés). Son ressenti pendant la grossesse était évalué par la question suivante : « Sur le plan psychologique, comment vous sentiez vous pendant votre grossesse ? Bien / Plutôt bien / Plutôt mal / Mal ». Les antécédents de DG étaient relevés par les sages- femmes à partir du dossier médical. Cependant, il est important de noter que les antécédents obstétricaux de macrosomie et les antécédents familiaux de diabète, qui sont deux des cinq facteurs de risque retenus dans les recommandations françaises de 2010, n’étaient pas recueillis dans l’étude Épifane. Les données médicales relatives à la grossesse, à l’accouchement et au nouveau-né étaient également issues du dossier médical. Les nouveau-nés étaient considérés comme ayant un poids élevé pour l’âge gestationnel si leur poids de naissance était supérieur au 90e percentile pour l’âge gestationnel de références françaises 14 et comme macrosome si leur poids était supérieur à 4 kg.
Identification des cas de diabète préexistant et gestationnel
Nous avons identifié séquentiellement les cas de diabète préexistant (N=10) puis, parmi les femmes restantes, les cas de DG. Les données suivantes ont été utilisées pour identifier les cas de diabète préexistant : diabète préexistant à la grossesse relevé par la sage-femme, traitement pharmacologique pour diabète préexistant relevé par la sage-femme, diabète préexistant déclaré par la mère à la maternité, diabète déclaré par la mère à 1 mois postpartum, traitement pharmacologique pour diabète déclaré par la mère à 1 mois, 4 mois, 8 mois et 12 mois après l’accouchement. Les femmes pour lesquelles ont été retrouvées au moins deux mentions d’un diabète préexistant ont été considérées comme ayant un DG. Le diagnostic et le traitement par insuline du DG ont été identifiés à partir des déclarations des mères, ainsi que par les sages-femmes dans le dossier médical. En cas de discordance, on considérait que la femme avait eu un diagnostic de DG si la sage-femme l’avait relevé dans le dossier médical ou si la mère déclarait un DG et avoir bénéficié d’au moins une mesure de prise en charge pour ce DG (recours à un endocrinologue, diététicien(ne), prescription d’un régime alimentaire, recommandations relatives à l’activité physique, utilisation d’un lecteur glycémique, traitement par insuline). Un traitement par insuline était considéré s’il était déclaré par la sage-femme ou par la mère.
Identification des femmes ayant bénéficié d’un dépistage
Chez l’ensemble des mères de l’étude, l’information concernant le dépistage de DG était issue uniquement de la réponse de la mère à la question : « Avez-vous effectué un test pour rechercher un diabète gestationnel (diabète de la grossesse) pendant cette grossesse ? (Ce test consiste à boire une solution sucrée puis à faire une prise de sang pour vérifier le taux de sucre) ». Cette question concernait donc uniquement le dépistage par une charge en glucose, HGPO, qui est effectivement recommandé entre 24 et 28 SA mais excluait les dépistages précoces à l’aide d’une glycémie à jeun, la glycémie postprandiale ou d’autres types de dépistages parfois utilisés. La variable de dépistage utilisée dans les analyses est donc basée sur le bénéfice d’un test de charge en glucose, mais nous avons de plus considéré que toutes les femmes diagnostiquées pour un DG avaient bénéficié d’un dépistage, ce qui ajoute aux femmes dépistées par HGPO les femmes avec un diabète gestationnel dépisté par d’autres moyens que l’HGPO.
Population d’étude
Dans les 136 maternités participantes, parmi les mères auxquelles l’étude a été proposée (n=4 152), 81% ont accepté de participer. Les mères ayant accepté de participer étaient plus souvent en couple et employées à temps plein avant leur grossesse (données présentées précédemment 13) que celles de l’ENP de 2010 6. Parmi les 3 368 dyades mère-enfant incluses dans l’étude Épifane lors de leur séjour à la maternité, notre analyse en a inclus 3 353 (soit 99,6% de l’échantillon initial) pour lesquelles le questionnaire renseigné par la mère à la maternité et le questionnaire renseigné par la sage-femme étaient tous les deux disponibles. Les femmes identifiées avec un diabète préexistant à la grossesse ont été exclues des analyses portant sur le dépistage (n=10 cas).
Analyses statistiques
Afin de tenir compte des probabilités inégales d’inclusion et des non-réponses totales, un redressement de l’échantillon a été effectué. Les données ont été pondérées par l’inverse des probabilités d’inclusion et par calage sur marge sur des variables issues de l’ENP 2010 : l’âge, le statut matrimonial, le niveau d’études, le type de grossesse (simple, multiple), le statut de l’établissement (privé, public) et son type d’autorisation (niveau I, II ou III) 12. Les estimations présentées sont pondérées et tiennent compte du plan de sondage complexe, ainsi que toutes les autres analyses réalisées. En revanche, les effectifs présentés sont ceux de l’échantillon. La prévalence du DG et la fréquence de dépistage sont présentées en fonction de différents facteurs sociodémographiques ou médicaux, et les caractéristiques de l’accouchement et de l’enfant à la naissance en fonction du statut diabétique de la mère. Les associations potentielles ont été testées grâce à des tests du Chi2 de Rao-Scott de la procédure SURVEYFREQ (SAS® EG 8.2). Puis des modèles multivariés logistiques, avec d’une part le diagnostic de DG et, d’autre part, le fait d’être dépistée comme variable dépendante et les facteurs explicatifs significativement associés dans les analyses bivariées ont été mis en œuvre en utilisant la procédure SURVEYLOGISTIC. Des analyses par sous-population ont été réalisées pour la description de la prise en charge des femmes ayant présenté un DG. Un modèle logistique a également été réalisé pour étudier les facteurs associés au ressenti de la mère pendant la grossesse.
Résultats
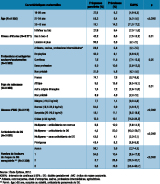
Dans cette étude, 19,1% des femmes étaient âgées de 35 ans et plus, 28,4% étaient en surpoids ou obèses, 74,7% étaient nées en France, 27,8% avaient un niveau inférieur au baccalauréat, 7,5% étaient ouvrières et 6,9% sans profession (tableau 1). Cinquante-huit pour cent des femmes ne présentaient aucun des trois facteurs de risque de DG recueillis dans l’étude (âge ≥35 ans, surpoids/obésité ou antécédents de diabète gestationnel) ; certaines d’entre elles pouvaient néanmoins présenter l’un des autres facteurs de risque non renseignés dans l’étude, à savoir les antécédents obstétricaux de macrosomie ou les antécédents familiaux de diabète.
Prévalence du diabète gestationnel
La prévalence du DG était de 8,0% (intervalle de confiance à 95%, IC95%: [7,0-9,0]), plus élevée chez les femmes âgées de 35 ans et plus (14,2%), en surpoids/obèses (11,1 et 19,1% respectivement) ou avec des antécédents de DG (50,0%) (tableau 1). Dans l’analyse bivariée, elle apparaissait également plus élevée chez les femmes nées en Afrique (Maghreb et Afrique subsaharienne réunis, 13,8%), chez les femmes ayant un niveau d’études inférieur au baccalauréat (9,4%) et chez les ouvrières (11,3%) et les femmes sans profession (10,6%). La prévalence ne variait pas significativement avec le fait de vivre en couple, la parité, la grossesse multiple, le bénéfice et les modalités de couverture maladie complémentaire, ou encore la consommation de tabac ou d’alcool avant ou pendant la grossesse (données non présentées). Dans l’analyse multivariée incluant l’ensemble des facteurs associés au DG en bivarié à l’exception du nombre de facteurs de risque, l’âge (odds ratio, OR=2,7 [1,6;4,7]) pour les femmes âgées de 35 ans et plus vs. celles entre 18-26 ans), le surpoids (OR=2,1 [1,5;3,1]) et l’obésité (OR=2,9 [1,9;4,5]) par rapport à une corpulence normale, les antécédents de DG chez les multipares (OR=25,7 [15,3;43,0]) par rapport aux multipares sans antécédents, le fait d’être ouvrière (OR=2,6 [1,4;5,0]) et les femmes sans profession (OR=1,5 [1,0;2,4]) par rapport aux femmes de la catégorie « artisans, commerçantes, chefs d’entreprise, cadres, professions intermédiaires, agricultrices » restaient associés au DG. Le niveau d’études et le pays de naissance n’étaient pas significativement associés au DG (p=0,78 et p=0,10 respectivement). Ces résultats étaient similaires lorsque l’échantillon était restreint aux femmes qui avaient bénéficié d’un dépistage, à l’exception des femmes sans profession (OR=1,4 [0,9;2,2]).
 Agrandir l'image
Agrandir l'image
Dépistage et facteurs associés
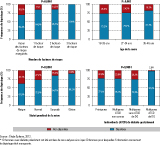
Dans notre échantillon, 76,1% [74,5-77,6] des femmes déclaraient avoir été dépistées. Les femmes présentant un ou plusieurs facteurs de risque recueillis étaient plus fréquemment dépistées 85,2% [83,2-87,3] que celles n’en présentant pas (69,4% [67,3-71,6]). Le taux de dépistage augmentait avec le nombre de facteurs de risque (figure). Malgré le taux de dépistage globalement élevé dans la population (18,3% [14,9-21,6]) des femmes âgées de 35 ans et plus, 15,3% [12,2-18,4] des femmes en surpoids avant la grossesse, 9,8% [5,7-13,8] des femmes obèses et 2,8% [0,1-5,5] des femmes ayant un antécédent de DG déclaraient ne pas avoir été dépistées. Dans l’analyse bivariée, le taux de dépistage ne variait pas significativement en fonction du pays de naissance, de la PCS, du niveau d’études de la mère, du fait de vivre en couple, de la parité, du type de grossesse (unique/multiple), ni du bénéfice et des modalités de couverture maladie complémentaire (données non présentées). En revanche, on retrouvait des taux de dépistage significativement plus faibles chez les fumeuses avant grossesse que chez les non fumeuses (73,1% vs. 76,7% ; p=0,03), et chez les femmes bénéficiant de la Couverture maladie universelle ou de l’Aide médicale d’État (68,5%), par rapport aux autres femmes (76,6% ; p=0,01). Néanmoins, dans l’analyse multivariée, seuls l’âge (≥35 ans vs. 18-26 ans ; OR=1,4 [1,0;2,0]), le surpoids (OR=2,1 [1,6;2,7]) et l’obésité (OR=3,6 [2,2;5,8]) par rapport aux femmes de corpulence normale, et les antécédents de DG (OR=8,2 [2,9;23,0]) par rapport aux primipares, restaient significativement associés au fait d’avoir bénéficié d’un dépistage.
 Agrandir l'image
Agrandir l'image
Prise en charge du diabète gestationnel
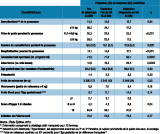
Concernant la prise en charge pendant la grossesse des femmes avec un diagnostic de DG (n=262), 86,5% de ces dernières déclaraient avoir eu recours à un endocrinologue ou à un(e) diététicien(ne), 91,6% déclaraient qu’un régime leur avait été prescrit, 48,8% qu’elles avaient reçu des recommandations d’activité physique, et 81,8% qu’elles avaient utilisé un lecteur glycémique. La proportion des femmes mises sous insuline était de 26,9% (tableau 2).
 Agrandir l'image
Agrandir l'image
Associations du DG avec les caractéristiques de la grossesse, de l’accouchement et du nouveau-né
Pendant la grossesse, les femmes avec un diagnostic de DG bénéficiaient de davantage de consultations prénatales (à l’hôpital ou en libéral) et étaient plus fréquemment hospitalisées (27,1% vs. 14,0% pour les dépistées non diagnostiquées et 15,1% pour les non dépistées). L’accouchement était moins fréquemment spontané et plus souvent par césarienne chez les femmes avec DG que chez les autres femmes (tableau 3). Le terme moyen à la naissance était légèrement inférieur chez les enfants de mère avec DG. Les poids de naissance des enfants de mères avec DG ou ayant été dépistées étaient très similaires mais supérieurs au poids des enfants des femmes non dépistées. Malgré des fréquences de macrosomie et de « poids élevé pour l’âge gestationnel » plus importantes chez les femmes avec DG que chez les autres, les différences n’étaient pas statistiquement significatives. Parmi les femmes non dépistées, les taux de macrosomie et de poids élevé pour l’âge gestationnel ne différaient pas significativement selon la présence ou non de facteurs de risque, alors que les taux de déclenchement et de césarienne étaient supérieurs chez les femmes avec facteurs de risque (données non présentées).
 Agrandir l'image
Agrandir l'image
Associations du DG avec le ressenti des femmes pendant la grossesse
Les femmes diagnostiquées pour un DG étaient plus à risque de ressenti négatif pendant la grossesse (13,7% [9,2-18,2]) que les autres femmes (8,8% [7,7-9,9]). Après ajustement sur l’éducation maternelle, le pays de naissance, la corpulence de la mère avant la grossesse, le gain de poids pendant la grossesse et d’autres complications de la grossesse, l’OR était de 1,62 [1,03;2,55] mais devenait non significatif (OR ajusté =1,44 [0,90;2,30]) après ajustement supplémentaire sur le séjour à l’hôpital pendant la grossesse.
Discussion
En France métropolitaine, en 2012, selon les données de l’étude Épifane, la prévalence du DG était de 8,0%. Bien que les estimations et les comparaisons de la prévalence du DG soient difficiles entre les pays du fait de la variabilité des pratiques de dépistage et de l’ancienneté de certaines données, la prévalence du DG a été estimée à environ 2 à 6% des grossesses en Europe, dans les années 2000, avec des valeurs plus élevées dans le sud de l’Europe 15. Cependant, il faut prendre en compte le fait que cette prévalence française de 8% a été estimée après le changement des recommandations. D’après une étude réalisée dans le Nord-Pas-de-Calais, l’utilisation des nouveaux seuils multiplierait par deux le taux de DG, avec une prévalence qui est passée de 6,3% en 1996 à 14% en 2011 16. Au niveau national, l’impact des recommandations semble moindre, avec une prévalence de 7,2% dans l’ENP en 2010 contre 8% dans notre étude en 2012, loin donc d’un doublement, voire d’un triplement de la prévalence évoqué comme une conséquence de l’application des seuils glycémiques recommandés par l’IADPSG dans le cadre d’un dépistage universel 11. Ceci pourrait s’expliquer par la mise en place progressive de ces recommandations. La mise en place d’un système de surveillance épidémiologique du DG à partir des données du Système national d’information inter-régimes de l’assurance maladie (Sniiram) permettra d’étudier les évolutions de sa prévalence d’une manière durable, avec une identification via un algorithme basé sur les données de consommations médicales et des hospitalisations (http://www.invs.sante.fr/Dossiers-thematiques/Maladies-chroniques-et-traumatismes/Diabete/Donnees-epidemiologiques/Diabete-et-grossesse).
L’augmentation de la prévalence du DG avec l’âge et la corpulence élevée est connue 17. Une méta-analyse récente a également montré que le taux de récurrence du DG dans les grossesses ultérieures était de 48% 18. Par ailleurs, une étude française dans une zone à forte diversité ethnique a suggéré récemment que, par rapport aux femmes européennes, la prévalence du DG serait plus élevée chez les femmes originaires du Maghreb et moins élevée chez celles originaires d’Afrique subsaharienne 19. Dans notre étude, les femmes nées en Afrique avaient également la plus forte prévalence. Néanmoins, du fait de faibles effectifs, les femmes originaires du Maghreb et d’Afrique subsaharienne n’ont pas pu être analysées séparément. Il aurait été intéressant également d’étudier le sous-groupe des femmes d’origine asiatique. De même, nous n’avons pas pu investiguer les disparités régionales et caractériser finement d’éventuelles inégalités d’accès au dépistage. Ainsi, d’autres analyses seraient nécessaires sur de plus grands échantillons pour étudier ces disparités. Concernant la PCS, Bo et coll. ont montré une prévalence plus élevée chez les ouvrières 20. La littérature est plus contrastée concernant les associations avec le niveau d’études, reflétant probablement des choix d’ajustements différents dans les modèles 20,21.
La fréquence de dépistage semble avoir diminué entre 2010 (85,9% dans l’ENP) et 2012 (75,9% dans notre étude), ce qui pouvait être attendu avec la mise en place du dépistage ciblant des femmes ayant des facteurs de risque. Il faut noter que notre définition du dépistage basée essentiellement sur le test de charge en glucose sous-estime le taux de dépistage. Cependant, la question étant posée à la mère à la maternité, il a semblé que les femmes auraient des difficultés à donner des informations fiables sur les glycémies à jeun précoces, parfois réalisées en même temps que plusieurs autres dosages biologiques. A contrario, les femmes se remémorent bien le test de charge en glucose.
Malgré tout, la fréquence du dépistage, même sous-estimée, reste relativement élevée par rapport à d’autres pays 22,23,24. Une analyse récente en Lombardie (Italie) a conclu à un taux de dépistage de 30% en 2007-2010 pour un dépistage recommandé pour des facteurs de risque très similaires à ceux des recommandations françaises. Ce taux était de 68% dans une étude américaine dans une population âgée de plus de 25 ans et de 89% sur la période 2000-2010 dans une étude israélienne où un dépistage universel est recommandé 22,24. Néanmoins, malgré des fréquences de dépistage chez les femmes à risque plus élevées qu’en population générale, les données de l’étude Épifane montrent qu’il reste une fraction non négligeable de femmes à risque qui ne sont pas dépistées, notamment celles âgées de plus de 35 ans, en surpoids ou obèses, ou ayant des antécédents de DG. L’absence d’association entre dépistage et pays de naissance, niveau d’études, PCS est cohérente avec l’absence de ces facteurs dans les critères de dépistage. Néanmoins, la prévalence plus élevée du DG chez les femmes nées en Afrique pose la question de sa prise en compte parmi ces critères de dépistage. Cosson et coll. ont récemment montré que les facteurs de risque sélectionnés dans les recommandations françaises n’avaient pas la même valeur prédictive pour toutes les origines ethniques 19. Notamment, dans leur étude, ces critères ne prédisaient pas le DG chez les femmes d’origine asiatique, indienne, pakistanaise et sri-lankaise. Une réflexion similaire pourrait être menée sur l’apport de la prise en compte de la PCS dans les critères de dépistage, bien que le niveau de preuve soit plus faible que pour l’origine ethnique.
Concernant la prise en charge de la grossesse, 86,5% des femmes avec un DG diagnostiqué avaient consulté un endocrinologue ou un(e) diététicien(ne). Une large proportion (48,8%) des femmes avaient reçu des recommandations relatives à l’activité physique et l’utilisation d’un lecteur glycémique était très répandue (81,8%). À notre connaissance, il s’agit des premières données de ce type en population générale. Le taux de traitement par insuline avait a contrario déjà été estimé en 2010 dans l’ENP et était proche de celui retrouvé dans notre étude (23,1% dans l’ENP contre 26,9% ici).
Alors que la prise de poids gestationnelle était très similaire chez les non dépistées et les dépistées négatives, nos données montrent une prise de poids moindre chez les femmes présentant un DG, certainement du fait de la prise en charge. Elles ont cependant un taux de césarienne et de déclenchement plus élevé (avec un terme des enfants un peu plus faible). Il existait un gradient positif de la fréquence de la macrosomie, avec le taux le plus faible chez les non dépistées (6,1%), puis 7,9% chez les dépistées négatives et 9,4% chez les DG. Ceci pourrait suggérer que les femmes non dépistées sont effectivement moins à risque de macrosomie que les autres. Néanmoins, ceci demande à être confirmé par d’autres études. En effet, alors que les poids moyens étaient significativement différents dans les trois groupes, les taux de macrosomie n’étaient pas quant à eux significativement différents, probablement du fait de l’effectif de notre échantillon. On peut noter que 26,4% des enfants de mère avec un diagnostic de DG naissaient par césarienne alors que le taux de macrosomie était de 9,4%. Le taux d’hospitalisation pendant la grossesse était similaire chez les non dépistées et les dépistées négatives (14%) mais était doublé chez les femmes avec DG (27,1%). Ceci représente une proportion importante des femmes avec un DG et devrait donc être approfondi par d’autres études, le motif d’hospitalisation (déséquilibre métabolique, complications obstétricales…) n’ayant pas été collecté dans Épifane. Les femmes ayant présenté un DG avaient un ressenti plus négatif de leur grossesse. Ceci a déjà été suggéré 25, mais nos données indiquent que cet effet passe notamment par un taux d’hospitalisation plus élevé. La prise en charge psychosociale de ces femmes n’est donc pas à négliger. Une étude qualitative récente a cependant montré des effets bénéfiques liés à l’annonce du diagnostic de DG 26. Les femmes concernées ont indiqué être motivées pour modifier leurs comportements de santé après le diagnostic qu’elles considéraient comme un signal de la nécessité de changer leur mode de vie 26.
Les forces de cette étude étaient son échantillonnage représentatif de la population française, comme le montrent les caractéristiques de notre population, très similaires à celles de l’ENP en 2010 6, et la possibilité de recouper les informations concernant le statut diabétique des femmes pendant la grossesse à partir des données du dossier médical et des déclarations de la mère, même si les valeurs des dosages de glycémie n’étaient pas disponibles. De plus, à notre connaissance, il n’existait pas jusqu’à présent de données nationales sur la prise en charge spécifique des femmes présentant un DG. Les limites étaient principalement dues à l’impossibilité de prendre en compte l’ensemble des facteurs de risque listés dans les recommandations. De plus, la question posée sur le dépistage concernait exclusivement le test de charge en glucose et l’information venant uniquement des mères n’a pas pu être recoupée avec celles du dossier médical. On ne peut donc totalement exclure que le reliquat de femmes à risque que nous avons catégorisées comme non dépistées l’ait été du fait d’une mauvaise compréhension de la question par ces femmes. Finalement, dans cette analyse, la taille d’échantillon était parfois insuffisante pour étudier plus en détails certains aspects tels que l’association du pays de naissance avec le risque de DG, ou pour investiguer d’éventuelles disparités géographiques. D’autres sources de données, comme l’étude française Elfe 27 ou les données de l’Assurance maladie 28, permettront d’étudier ces aspects.
En conclusion, en France métropolitaine, en 2012, selon les données d’Épifane, la prévalence du DG était de 8%. La proportion de femmes dépistées restait élevée (76%) malgré la recommandation d’un dépistage sélectif. Pourtant, toutes les femmes présentant des facteurs de risque n’avaient pas été dépistées. Les pratiques de dépistage pourraient être améliorées chez les femmes âgées de plus de 35 ans, en situation de surpoids ou d’obésité, ou ayant des antécédents de DG. De plus, le DG peut être considéré comme un signe avant-coureur du diabète de type 2 et, plus généralement, d’anomalies métaboliques, particulièrement chez ces femmes à risque. L’incidence cumulative de diabète de type 2 a été estimée entre 30 et 50% cinq ans après le diagnostic de diabète gestationnel, avec une variabilité en fonction de l’origine ethnique 29. Le diagnostic d’un DG permettrait ainsi d’identifier précocement les femmes (et éventuellement leur enfant) susceptibles de bénéficier au mieux de programmes de promotion de la santé ciblant des facteurs modifiables, notamment l’activité physique et l’alimentation.




