Incidence de l’anisakidose en France. Enquête rétrospective 2010-2014
// Incidence of anisakidosis in France. Retrospective survey, 2010-2014
Résumé
L’objectif de cette étude était d’estimer l’incidence de l’anisakidose en France depuis l’émergence de nouvelles habitudes culinaires telles que la consommation croissante de poisson cru (sushis).
Cette enquête rétrospective a été réalisée sur les années 2010 à 2014 et a consisté en un recueil des cas auprès de tous les laboratoires hospitalo-universitaires de parasitologie-mycologie de France. Elle a été complétée par une analyse des données du Réseau national d’allergovigilance (RAV) et des données du Programme médicalisé des systèmes d’information (PMSI).
Trente-sept cas d’anisakidose ont pu être répertoriés par les laboratoires de parasitologie : 6 cas certains avec mise en évidence du ver dans un prélèvement digestif, 13 cas possibles définis par des douleurs abdominales après consommation de poisson cru et une recherche positive de précipitines anti-Anisakis, et 18 cas d’anisakidose allergique définie par des manifestations allergiques aiguës après consommation de poisson et associées à la présence d’IgE anti-Anisakis. Six cas supplémentaires d’allergie sévère aux anisakidés ont été rapportés au RAV sur cette même période. L’analyse des données du PMSI a permis d’identifier 43 patients hospitalisés avec un code d’anisakidose en diagnostic principal ou en diagnostic associé.
Par rapport à des études antérieures, cette enquête objective une diminution des anisakidoses, mais montre que le potentiel allergisant des anisakidés est en émergence et que son importance en santé publique mériterait d’être davantage investiguée.
Abstract
The objective of this study was to evaluate the incidence of anisakidosis in France in order to assess the impact of new culinary habits such as the increasing consumption of raw/undercooked fish (sushi).
This retrospective survey was carried out over the years 2010-2014 through case collection among all parasitology-mycology laboratories of French university hospitals. This survey was supplemented by an analysis of data from the Allergy-Vigilance Network and from the French Hospital Medical Information Database (PMSI).
Thirty seven cases of anisakidosis were notified by all laboratories of parasitology: 6 confirmed cases with evidence of a worm in a digestive sample, 13 possible cases with abdominal pain after consumption of raw fish with detection of anti-Anisakis precipitins, and 18 allergic cases defined as acute allergic manifestations after consumption of fish and associated with specific Anisakis IgE. In addition, 6 cases of severe allergy to Anisakis were reported to the Allergy-Vigilance Network. The analysis of the PMSI database identified 43 hospitalized cases for whom anisakidosis was reported as the main or associated diagnosis of hospitalisation.
Compared to previous studies, this study indicates a decrease of cases of anisakidosis, but illustrates the emerging allergic potential of Anisakidae and its importance for public health in France could be better evaluated.
Introduction
L’anisakidose 1,2 est l’infestation de l’homme par des larves de nématodes de la famille des Anisakidés, parasites à l’état adulte du tube digestif de mammifères marins tels que les cétacés (dauphins, marsouins…) et les pinnipèdes (phoques). Les œufs de ces parasites sont émis dans la mer et libèrent des larves qui sont ingérées par des micro-crustacés planctoniques. Ce zooplancton fait partie de l’alimentation de nombreux poissons et ces larves se transforment dans l’intestin de ces poissons. Les larves deviendront adultes quand elles seront ingérées par les mammifères marins. La contamination humaine se produit après ingestion de poisson de mer cru ou mal cuit. Chez l’Homme, les larves ne peuvent plus évoluer chez cet hôte inhabituel (elles sont en impasse parasitaire) mais leur présence provoque des manifestations aiguës (douleurs épigastriques, simulant un ulcère, provoquées par la fixation à la muqueuse gastroduodénale d’une larve quelques heures après la contamination), chroniques (granulome éosinophile autour d’une larve enchâssée dans l’intestin et simulant une tumeur intestinale) ou allergiques (choc anaphylactique, œdème de Quincke, urticaire aiguë récidivante ou chronique, asthme, œdème segmentaire de l’intestin pouvant conduire à une occlusion). Les genres Anisakis et Pseudoterranova sont principalement impliqués en pathologie humaine. Bourée et coll. rapportaient, en 1995, 25 cas qu’ils avaient personnellement observés et identifiaient 30 cas précédemment publiés 3. Des observations isolées d’anisakidose sont toujours régulièrement rapportées en France mais demeurent peu nombreuses à être publiées 4,5. Des études anciennes avaient montré que les prévalences de l’infestation des poissons de mer par ces parasites étaient importantes 3,6. Ces données sont confirmées par des études récentes. Gay et coll. 7 ont trouvé des prévalences variant entre 6,6% et 86,7% selon les lots de maquereaux et de merlans provenant de pêcheurs de Boulogne-sur-Mer. Un des axes du récent programme Fish-Parasites (ANR-10-ALIA-004) était la collecte de données de prévalence et d’identification des Anisakidae dans des poissons appartenant aux quinze espèces les plus consommées en France. Ainsi 1 781 poissons ont été échantillonnés, entre 2011 et 2014, selon un protocole standardisé pour collecter et identifier les parasites par biologie moléculaire. Aucun Anisakidae n’a été isolé dans 44% des poissons échantillonnés, tandis que 33% des poissons présentaient des Anisakidae uniquement dans leurs viscères et 23% présentaient des Anisakidae soit uniquement dans leurs filets, soit dans leurs filets et leurs viscères 8,9. Dans une étude menée en 2015, plus de 50% des filets de lingue bleue, de lieu noir, de lotte et de merlu étaient infestés 9.
Par ailleurs, depuis quelques années, une popularité croissante de la consommation de poisson cru sous forme de sushi, de carpaccio ou préparé selon de multiples autres recettes est observée en France. Les officines de restauration rapide servant et livrant à domicile des sushis, ainsi que les restaurants « japonais » ont vu leur nombre exploser. Une étude économique, publiée par Le Figaro le 5 février 2014, rapportait une augmentation du chiffre d’affaires de 25% entre 2011 et 2012 dans le secteur de la restauration « sushis ». Les achats des ménages de poissons crus préparés sont passés de 762 à 2 540 tonnes entre 2005 et 2014, soit une augmentation de 230% (source FranceAgrimer, Consommation des produits de la pêche et de l’aquaculture, 2015). Hubert et coll. avaient évalué l’incidence des cas d’anisakidose entre le 1er janvier 1985 et le 30 septembre 1987, en interrogeant l’ensemble des laboratoires hospitalo-universitaires de France métropolitaine 10. L’objectif de notre étude a été, en se basant sur une méthodologie d’enquête similaire, de mesurer l’évolution de l’incidence annuelle près de trois décennies après cette première enquête.
Matériel et méthodes
L’analyse de l’incidence de la maladie sur la période 2010-2014 a été effectuée en utilisant trois sources possibles d’information :
- un recueil des cas d’anisakidose auprès de tous les laboratoires hospitalo-universitaires de parasitologie-mycologie de France métropolitaine (réseau de l’Association française des enseignants de parasitologie et mycologie, Anofel) ;
- un recueil des cas d’anisakidose allergique auprès du Réseau national d’allergovigilance (RAV) 11 ;
- une analyse des données hospitalières du PMSI (Programme médicalisé des systèmes d’information).
Début janvier 2015, un questionnaire a été envoyé aux 35 laboratoires hospitalo-universitaires de parasitologie-mycologie de France. Les questions posées étaient « Avez-vous diagnostiqué des cas d’anisakidose sur la période 2010-2014 ? » et, si oui, « S’agissait-il de formes œsophagiennes, gastroduodénales, allergiques ou d’un granulome éosinophile ou d’une autre forme ? ». En cas de réponse positive, un questionnaire plus détaillé était envoyé aux laboratoires pour documenter les cas. Le service de parasitologie-mycologie du CHU de Lille, qui reçoit les demandes d’un laboratoire d’analyses médicales privé ayant un réseau national, a effectué, sur la période de l’enquête, 566 sérologies d’anisakidose par détection des précipitines en immunoélectrophorèse. Les prescripteurs des sérologies positives ont tous été interrogés afin d’obtenir des informations cliniques et épidémiologiques. Les cas ainsi identifiés ont été additionnés aux cas communiqués par les autres laboratoires hospitaliers de parasitologie. Les cas ont été classés en cas certains, cas possibles et cas allergiques. Un cas certain d’anisakidose est défini par l’identification d’un ver dans un prélèvement digestif. Un cas possible d’anisakidose est défini par des manifestations douloureuses épigastriques ou abdominales après consommation de poisson cru et la présence de précipitines anti-Anisakis. Un cas d’anisakidose allergique est défini par l’apparition de manifestations allergiques aiguës suivant l’ingestion de poisson, associées à la présence d’IgE anti-Anisakis.
Le RAV, créé en 2001, tient un registre des cas d’anaphylaxies sévères quelle qu’en soit l’étiologie. Les cas sont détaillés et validés par un panel d’experts. Les dossiers correspondant à des anaphylaxies aux anisakidés ont été extraits du registre.
Le PMSI est une base nationale de données hospitalières provenant de tous les hôpitaux, publics et privés français. Tous les séjours survenus entre 2010 et 2014, avec une « anisakiase » (code B81.0 de la Classification internationale des maladies 10e révision, mais ce terme est inexact dans la nomenclature parasitologique) enregistrée en diagnostic principal (DP) ou associé (DA) (1), ont été extraits du PMSI.
Résultats
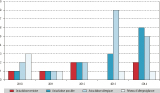
Une réponse au questionnaire a été retournée par l’ensemble des 35 laboratoires hospitalo-universitaires de parasitologie-mycologie. Globalement, 37 cas ont pu être recensés par les laboratoires de parasitologie du réseau Anofel et classés en 6 cas certains d’anisakidose avec mise en évidence du ver (16%), 13 cas possibles (35%) et 18 cas d’anisakidose allergique (49%) (figure 1). Parmi les 6 cas certains d’anisakidose, une forme œsophagienne s’était manifestée par quelques jours de brûlures rétro-sternales qui ont cessé lors de l’émission d’un ver à l’occasion d’un vomissement, associée à un dosage d’IgE positif 5. Quatre formes gastroduodénales se caractérisaient par l’observation d’un (ou plusieurs) ver(s) à la fibroscopie gastrique (avec un œdème allergique de la lèvre pour l’un des cas). Le 6e cas certain était une forme colique, diagnostiquée lors de la découverte fortuite de larves avec un granulome éosinophile du côlon lors d’une coloscopie.
Les cas d’anisakidose allergique se caractérisaient par diverses manifestations cutanées (prurit, urticaire, œdème des lèvres ou du visage) ou par un malaise général et parfois par un choc anaphylactique. Ces formes étaient parfois associées à des douleurs épigastriques ou abdominales aiguës. L’âge de ces 37 cas variait de 11 à 69 ans et il existait une prépondérance féminine (25 femmes contre 12 hommes). Quelle que soit la forme clinique, les IgE spécifiques Anisakis étaient toujours positives quand elles étaient recherchées, même en l’absence de manifestations allergiques patentes. Une hyperéosinophilie sanguine était parfois mentionnée mais cette donnée n’a pas été recherchée systématiquement. Les poissons incriminés dans la survenue des 6 cas certains et cités par les patients étaient divers : maquereau (1 cas), cabillaud (1 cas), anchois (1 cas), daurade (1 cas), poisson cru non identifié (1 cas). Pour le 6e cas, plusieurs espèces de poissons avaient été consommées crues lors d’un même repas, rendant impossible l’imputabilité de l’une ou l’autre espèce (hareng, saumon, sardine, truite).
Les cas d’anisakidose certains ont été traités par extirpation des larves lors de la fibroscopie et/ou par des cures d’albendazole. Les cas suspects ont parfois été traités par albendazole. Les cas d’anisakidose allergique ont bénéficié d’antihistaminiques et de corticoïdes locaux et par voie générale.
En plus de ces cas rapportés par les laboratoires hospitaliers, 6 cas d’allergie sévère aux anisakidés ont été signalés par le RAV sur la même période (figure 1). Il s’agissait de 5 femmes et d’un homme, âgés de 38 à 80 ans. Les poissons incriminés dans la survenue de ces 6 allergies sévères étaient : maquereau (1 cas), colin (1 cas), hareng (1 cas), merlu (1 cas), saumon et thon (1 cas) et merlu, saumon et maquereau pour le dernier cas. Quatre patients ont présenté une urticaire, 3 des signes de choc anaphylactique. Cinq patients ont été traités par corticoïdes et 1 par adrénaline. Tous les patients présentaient des IgE dirigés contre les Anisakis, et 1 seul sur les 6 avait une co-sensibilisation au poisson (merlu). Sur la période 2010-2014, 112 à 141 cas annuels d’anaphylaxie sévère toutes causes confondues ont été rapportés au RAV par des allergologues français ; les allergies aux Anisakis représentent donc sur cette période 0,95% des 627 anaphylaxies sévères rapportées au RAV et 1% des 600 anaphylaxies sévères dont la cause a été identifiée.
 Agrandir l'image
Agrandir l'image
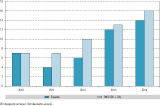
L’analyse des données du PMSI sur la même période de 5 ans a permis d’identifier 43 patients ayant été hospitalisés au moins une fois avec un diagnostic d’anisakidose. Pour 19 d’entre eux (44%), ce diagnostic était enregistré en tant que motif principal d’hospitalisation ; le diagnostic d’anisakidose étant associé pour les 34 autres. Le DP pour ces 34 cas était « diverses pathologies digestives » pour 20 d’entre eux (dont 9 œsophagienne ou gastrique), des examens de contrôle après traitement pour 9 cas et des causes diverses pour 5 cas. Une augmentation du nombre de cas est observée entre 2010 et 2014 (figure 2). L’âge médian des cas était de 51 ans (8-81 ans) et il y avait davantage de femmes (62%) que d’hommes (38%).
 Agrandir l'image
Agrandir l'image
Discussion
Notre étude est la première à estimer l’incidence de l’anisakidose en France depuis l’étude d’Hubert et coll. publiée en 1987 10. Sur la période d’étude de 5 ans, 4 à 14 cas ont été recensés chaque année. En excluant les 18 cas d’anisakidose allergique de notre étude, pour pouvoir la comparer à celle d’Hubert et coll. (dosage des IgE spécifiques d’Anisakis non disponible et pathologie non connue à l’époque), nous identifions ainsi 19 cas sur 60 mois (soit 0,31 cas/mois) alors que l’étude précédente avait repéré 21 cas sur 33 mois (0,63 cas/mois). Sur ces 21 cas, 11 étaient des patients avec des sérologies positives et ayant présenté des douleurs abdominales après consommation de poisson cru. Ces cas pouvaient être considérés comme des cas possibles et non comme des cas certains. En ne considérant que les cas certains, l’incidence mensuelle des cas d’anisakidose était de 0,3/mois dans l’étude d’Hubert et coll., contre 0,1 cas/mois dans notre étude. Notre enquête semble donc objectiver une diminution de l’incidence des cas parasitologiques au cours des 25 dernières années.
Il est difficile de comparer les données issues de l’enquête auprès de laboratoires hospitaliers avec celles issues de bases médico-administratives telles que le PMSI, qui sont anonymes. Nous n’avons donc aucun moyen de savoir si le PMSI inclut les cas que nous avons pu identifier par le réseau Anofel ou le RAV. Néanmoins, dans notre étude, la tendance annuelle et la répartition par sexe sont comparables entres les deux sources de données, avec une augmentation du nombre de cas entre 2011 et 2014 et une prédominance des cas chez les femmes. Cette prédominance féminine n’est pas connue ; elle n’est mentionnée que par un article coréen de 2015 12 et n’avait pas été retrouvée dans l’étude d’Hubert et coll. 10. Les femmes seraient-elles plus amatrices de poisson cru que les hommes ? Sont-elles plus impliquées dans la préparation domestique des plats à base de poisson cru ? Une étude japonaise de 2006 a montré que les femmes étaient beaucoup plus consommatrices de sushis que les hommes 13.
L’incidence estimée par le PMSI porte uniquement sur les cas hospitalisés et sous-estime donc l’incidence en population générale, mais elle peut également être surestimée par des biais de classification et de codage. Pour 62% des cas identifiés par le PMSI, la durée d’hospitalisation était de 0 jour et ces cas pourraient correspondre à des demandes de sérologie d’anisakidose plutôt qu’à de vrais cas diagnostiqués et hospitalisés. Une analyse du PMSI pour les années 1997, 1998 et 1999 avait montré, respectivement, 3, 5 et 11 hospitalisations sur ces années avec une anisakiase retenue comme DP (soit en moyenne 6 cas/an) 14 ; l’incidence de l’anisakiase était alors supérieure à celle évaluée par notre enquête récente (4 cas/an en moyenne). Cette tendance à la diminution des cas avait déjà été constatée par Petithory et coll. en 2006 6, qui avaient colligé 25 cas entre 1977 et 1991 (2 cas/an) et seulement 6 cas entre 1992 et 2005 (1 cas tous les 2 ans). Les auteurs invoquaient, dans cette diminution, la responsabilité d’une directive européenne de 1991 rendant obligatoire la congélation du poisson destiné à être consommé cru.
La présente enquête a, cependant, des limites. Il y a certainement beaucoup de cas asymptomatiques ou pauci-symptomatiques qui n’entraînent pas de consultation. Par ailleurs, le diagnostic de certitude ne peut être apporté que par l’observation de la larve, ce qui limite ces diagnostics aux services pratiquant des fibroscopies et aux services de parasitologie. Ceci explique aussi, probablement, le peu de cas d’anisakidose publiés en France. En revanche, cette étude montre l’émergence de l’allergie aux anisakidés, comme le rapportent de nombreuses études internationales signalant une association entre l’allergie aux Anisakis et urticaire ou autres manifestations allergiques 6,15,16,17. Cependant, la détection d’IgE spécifiques à Anisakis simplex est sujette à caution car de multiples réactivités croisées, par le biais de l’allergène Ani s 3 (tropomyosine), sont observables entre les anisakidés et les acariens, les blattes, les crustacés et les mollusques. La détection d’IgE dirigées contre une fraction antigénique très spécifique (Ani s 1) n’est disponible que dans le multi-test ImmunoCAP® ISAC, d’un coût élevé 18. Le RAV a colligé pour la France, depuis 2002, 1 363 épisodes d’anaphylaxie grave (soit 68 à 141 cas par an) et, parmi ceux-ci, 8 cas liés aux Anisakis et cela uniquement depuis 2009 ; cette cause d’allergie est donc en émergence. En revanche, l’allergie aux Anisakis ne semble pas encore atteindre les niveaux observés en Espagne, où elle représentait 10,8% des causes d’anaphylaxie aux urgences d’un hôpital de Madrid en 2004-2005 19.
Cette faible incidence de la maladie chez l’Homme contraste avec la très forte prévalence de la parasitose constatée chez les poissons et les modifications récentes des habitudes culinaires ayant conduit à une plus grande consommation de poissons crus. Plusieurs causes peuvent expliquer ce contraste. Au niveau des professionnels de la mer, la parasitose est un souci majeur car elle peut conduire à retirer du commerce des lots de poisson manifestement trop parasités. Dans les ateliers de préparation, les fileyeurs, travaillant souvent sur des tables de transillumination, découpent les flancs et éliminent ainsi les parasites les plus patents. La réglementation sanitaire (voir encadré ci-après) est également très stricte et très précise 1,2 et interdit la commercialisation de poisson destiné à être mangé cru en restauration si celui-ci n’a pas été assaini par des mesures adéquates (congélation). De plus, de nombreux sushis sont préparés à base de poissons d’élevage qui ne sont pas, en général, parasités 9. Des émissions télévisées spécialisées ont promu des méthodes préventives (telles que la congélation) qui sont également popularisées sur le Web. Mais il n’est pas sûr que ces méthodes soient toujours appliquées par les particuliers. Enfin, même si l’étude de l’allergie aux anisakidés n’était pas l’objectif principal de ce travail, nous constatons néanmoins que le potentiel allergique des anisakidés émerge. Cet aspect parait bien connu et rapporté en Espagne ou en Italie 19,20, mais de telles études restent à mener en France, d’autant plus que ces allergènes sont thermostables et ne sont détruits ni par la cuisson, ni par la congélation 21.
Au total, notre enquête nationale sur l’anisakidose humaine montre que la moitié des cas sont des formes allergiques, l’autre moitié se répartissant entre cas certains et cas possibles. Parfois, sans que cela ait pu être quantifié dans notre enquête, ces formes peuvent être associées : cas certains présentant des manifestations allergiques, cas possibles sensibilisés (présence d’IgE spécifiques) et cas allergiques présentant des douleurs épigastriques immédiatement après consommation de poisson cru. Il n’est pas possible d’évaluer l’exhaustivité des cas recensés dans notre étude car un certain nombre d’inconnues demeurent : la part des cas asymptomatiques, la proportion des consultations lors de l’apparition de symptômes après consommation de poisson cru, la part des analyses spécifiques réalisées après les consultations. Cependant, il semble y avoir une bonne concordance entre les cas rapportés par le réseau des laboratoires hospitaliers de parasitologie-mycologie (Anofel) et les cas répertoriés dans le PMSI ; les données du PMSI semblent donc être un outil intéressant pour estimer les tendances de l’anisakidose en France.
Qu’est-ce que l’anisakiase ? Comment s’en prémunir ? Données recueillies sur Alim’Agri, site du Ministère de l’Agriculture, de l’Agroalimentaire et de la Forêt (le 13/12/2015) http://agriculture.gouv.fr/quest-ce-que-lanisakiase-comment-sen-premunir
Des mesures fixées par la réglementation européenne
La réglementation européenne permet de définir un cadre permettant de maîtriser le risque lié à la présence d’Anisakis. Chaque opérateur est responsable de la qualité sanitaire des produits qu’il met sur le marché. Aussi, le danger parasite doit être pris en compte dans l’analyse de risque, établie par le professionnel lors de la rédaction de son Plan de Maîtrise Sanitaire et les mesures de maîtrise adaptées en conséquence.
Une première mesure permet de réduire le risque de parasitose : l’éviscération pratiquée dès que possible après la capture et le respect de la chaîne du froid. Cette mesure permet de limiter la migration des larves dans la chair et par conséquent la présence d’allergènes.
Une seconde mesure consiste en des contrôles visuels permettant de s’assurer de l’absence de contamination, qui s’applique à tous les stades de la filière, quels que soient le poisson et son mode de préparation. Chaque opérateur doit s’assurer que le produit final ne contiendra pas de parasites après avoir procédé au tri du lot et à la préparation du poisson (parage, filetage).
Une troisième mesure concerne les produits de la pêche dont le mode de consommation ne permet pas de garantir l’absence de parasites viables : il convient d’appliquer un traitement par congélation assainissant (pendant un minimum de 24 heures à température inférieure ou égale à -20°C ou pendant un minimum de 15 heures à une température inférieure ou égale à -35°C).
Ainsi tous les produits de poissons vendus en l’état non transformés (cuisson insuffisante) ou avec traitement insuffisant, comme les sushis, les marinades, les carpaccios, les tartares, etc. doivent être obtenus à partir de poissons ayant subi ledit traitement. Cette mesure s’applique à tous les restaurateurs et autres fabricants de tels produits, sauf dans le cas très particulier où il est démontré que le poisson est exempt de parasites - ce qui est le cas de certains poissons d’élevage dont l’alimentation est parfaitement maîtrisée. Les services de contrôle officiels contrôlent l’ensemble de la filière.
Des recommandations pour le consommateur
Lors de la vente du produit au consommateur final en vue d’une consommation cru ou insuffisamment transformé, le professionnel doit être en mesure d’informer ce dernier en lui indiquant les espèces les mieux adaptées - poissons venant d’une filière où l’alimentation est maîtrisée. Pour les produits ne présentant pas suffisamment de garanties, il est recommandé de :
- traiter le poisson par assainissement par le froid : 7 jours dans un congélateur domestique peut être considéré comme suffisant pour tuer les larves d’Anisakis.
- cuisiner à cœur : 1 minute minimum à 60°C à cœur ou pour une cuisson au micro-onde 1 minute minimum à 70°C à cœur (la durée de cuisson dépendant de l’épaisseur). Il est important de s’assurer que la chair ne soit pas rose à l’arête.
Remerciements
À tous les laboratoires de parasitologie-mycologie du réseau Anofel qui ont communiqué leurs cas d’anisakidose et, pour le laboratoire de Toulouse, les résultats de leurs sérologies IgE. À tous les médecins prescripteurs de sérologie qui nous ont également communiqué leurs cas. À Sélina Tscheiller du Réseau d’allergovigilance (RAV) pour la communication des données épidémiologiques. Aux relecteurs de l’article et à Isabelle Villena pour leurs judicieuses suggestions.




