Épidémiologie de l’infection à papillomavirus humains chez les femmes âgées de 20 à 65 ans résidant dans des communes isolées de Guyane française : adapter l’action au territoire
// The epidemiology of Human Papilloma Virus in women aged 20-65 years living in remote villages in French Guiana: Adapting interventions to the territory
Résumé
Contexte –
Le cancer du col de l’utérus est le deuxième cancer féminin le plus fréquent en Guyane française. Des études ont montré que les populations résidant dans les communes isolées de l’intérieur du département débutent leur vie sexuelle de façon précoce et que le multipartenariat sexuel y est fréquent. Dans ce contexte, l’objectif principal de cette étude était de déterminer la prévalence de l’infection à papillomavirus humains (HPV) dans ces zones.
Méthodes –
Cette étude transversale multicentrique a été conduite auprès des femmes âgées de 20 à 65 ans résidant dans les communes isolées des fleuves Maroni et Oyapock. Les femmes étaient incluses sur la base du volontariat après avoir été informées du passage de l’équipe de l’étude via la radio locale et par les leaders d’opinion. La recherche d’infection à HPV et les analyses cytologiques ont été réalisées sur chaque prélèvement. L’infection à HPV était définie par la détection d’ADN viral par le kit de dépistage Greiner Bio One®. Les analyses cytologiques ont été décrites selon la classification de Bethesda 2001.
Résultats –
Au total, 643 femmes ont été incluses. La prévalence de l’infection à HPV, standardisée sur l’âge, était de 35%. La courbe de prévalence par classe d’âge présentait une forme en U : les femmes de plus de 50 ans avaient le plus haut risque d’être infectées par HPV, suivies par les femmes âgées de 20 à 29 ans. Par ailleurs, 26,1% des femmes ayant un frottis normal étaient infectées par le HPV. Les génotypes les plus fréquents étaient HPV52, HPV58 et HPV16. Sur les frottis interprétables, 1,16% des femmes avaient des lésions de haut grade (type HSIL).
Conclusions –
Le taux standardisé de prévalence de l’infection par le HPV en Guyane est parmi les plus élevés au monde. Les lésions cytologiques de type HSIL étaient près de 4 fois plus fréquentes qu’en Île-de-France. Étant donné l’importance de l’incidence du cancer du col de l’utérus en Guyane, ces résultats montrent qu’il est peut être préférable d’utiliser le test HPV plutôt que la cytologie. La vaccination anti-HPV, de préférence avec le nouveau vaccin nonavalent, semble être une mesure de prévention appropriée. Pour autant, cela reste un challenge de mettre en œuvre ces interventions dans cette région où une part importante de la population n’a pas d’assurance maladie.
Abstract
Context –
Cervical cancer is the second most frequent cancer of women in French Guiana. Studies have shown that populations living in remote villages in the interior of the territory have early sexual relations and that multiple sexual partnerships are frequent. Hence, the main objective of the study was to determine the prevalence of Human Papilloma Virus (HPV) in these areas.
Methods –
This multicentric cross sectional study was conducted in women aged 20 to 65 years, living in the remote villages along the
Maroni and Oyapock rivers. Women were included on a voluntary basis after being informed of the study team schedule through
radio address and key opinion leaders.
The search for HPV and cytologic examinations were performed on each sample. HPV infection was defined by the detection of
viral DNA using the Greiner Bio One® kit. Cytologic analyses were performed using the 2001 Bethesda classification.
Results –
Overall, 643 women were included in the study. Age-standardized HPV prevalence was 35%. The prevalence curve by age group showed a U-shaped pattern: women over 50 years had the highest risk of being infected by HPV, followed by women aged 20-29 years. In addition, 26.1% of women with a normal smear test had HPV infection. The most frequent genotypes were HPV52, HPV58, and HPV16. On interpretable smears 1.16% of women had high grade superficial intra-epithelial (HSIL) lesions.
Conclusions –
The standardized prevalence of HPV in French Guiana is among the highest in the world. HSIL cytological lesions were nearly 4 times more frequent than in the Île-de-France region. Given the importance of the incidence of cervical cancer in French Guiana, these results suggest it may be preferable to use HPV testing than cytology. Vaccination against HPV, preferably with the new nonavalent vaccine seems an appropriate prevention measure. However, this intervention will be a challenge to implement in this region where a significant proportion of the population is not covered by health insurance.
Introduction
Le cancer du col utérin est un problème de santé publique causé par l’infection à papillomavirus humains (HPV) 1. En termes de fréquence et de mortalité, ce cancer occupe le deuxième rang au niveau mondial et le premier dans les pays en développement 2.
En France, il se range au huitième rang des cancers féminins, avec plus de 3 000 nouveaux cas et environ 1 000 décès annuels 3. Les taux d’incidence du cancer du col utérin observés dans les Départements français d’Amérique sont intermédiaires entre ceux rencontrés en France métropolitaine 4 et ceux des pays voisins de la Caraïbe. Cette région figure parmi les plus touchées au monde 5. Globalement, en Guyane, ce cancer se situe au deuxième rang des cancers féminins, avec 70 cas recensés en 2003-2005 6. Cependant, de l’avis de tous les experts, la situation sur les fleuves Maroni et Oyapock est probablement plus grave qu’aux Antilles, en raison de la précocité des rapports sexuels et de l’importance du multipartenariat dans ces régions 7. Ainsi, sur le Maroni, l’épidémie de VIH par transmission sexuelle a explosé, la prévalence passant de 0 à plus de 1% en une décennie 8. Dans ce contexte, il semblait plausible que la prévalence HPV soit aussi élevée.
Une partie de la population guyanaise vit dans des villages isolés le long des fleuves, uniquement accessibles en pirogue ou en avion. Malgré la présence de centres de santé, l’accès aux soins reste difficile. Avec 77% des femmes issues des zones rurales présentant des lésions ayant métastasé au-delà du col contre 44% pour celles des zones urbaines 9, le délai de diagnostic du cancer du col est une perte de chance.
HPV16 et HPV18 étant impliqués dans 73% des cancers du col de l’utérus en Europe, la vaccination visant ces deux génotypes est désormais recommandée en France. Cependant, peu de données épidémiologiques concernant le virus HPV sont disponibles en Guyane, où les populations et les agents pathogènes sont très différents de ce que l’on retrouve en France hexagonale. Sur le Maroni, les Amérindiens, principalement des Wayana, vivent en amont de Maripasoula. Les Noirs marrons (Aluku, Djuka, Paramaka) sont des descendants d’esclaves s’étant enfuis des plantations du Suriname ; ils résident entre Maripasoula et Apatou. Sur l’Oyapock, on retrouve des populations amérindiennes Wayampi et Emerillon 10. Le relatif isolement géographique des Amérindiens et des Noirs marrons peut conduire à des caractéristiques épidémiologiques très spécifiques dans ces populations 7.
L’objectif principal de cette étude était de décrire la prévalence globale du HPV, mais aussi la prévalence des différents génotypes HPV et celle des anomalies cytologiques parmi les femmes âgées de 20 à 65 ans vivant dans des communes isolées des fleuves Maroni et Oyapock.
Méthodes
Population d’étude
La population cible était les femmes âgées de 20 à 65 ans des communes isolées des fleuves Maroni et Oyapock ayant déjà eu une activité sexuelle.
Critères d’inclusion
Toutes les femmes de la population cible étaient éligibles. Les critères de non-inclusion étaient les suivants : femmes ayant subi une hystérectomie et femmes enceintes depuis plus de trois mois.
Une recherche d’infection à l’HPV et des analyses cytologiques ont été réalisées sur chaque prélèvement. L’infection était définie par la détection de l’ADN viral par le kit Greiner-Bio-One®. Les analyses cytologiques sont décrites selon la classification de Bethesda 2001 11.
Collecte de données – période d’étude
Les données sociodémographiques, sur l’histoire sexuelle, gynécologique et obstétricale de ces femmes ont été collectées de façon standardisée. La collecte de données s’est déroulée entre décembre 2012 et septembre 2014.
Conduite de l’étude
En amont des inclusions, des missions de communication ont été réalisées dans les villages auprès de la population locale. Les autorités coutumières, les mairies et les centres de soins de chaque bourg ont été informés. Des messages radio et des campagnes d’affichage informaient des dates de présence de l’équipe de l’étude.
Les femmes se présentaient au centre de santé concerné. Le médecin faisait signer le consentement après explications. Un questionnaire était rempli avec la patiente par le médecin avant l’examen gynécologique et le prélèvement. Le médecin était assisté d’un logisticien coordinateur d’étude et d’un médiateur culturel. Les prélèvements étaient conservés dans une glacière avant d’être envoyés aux laboratoires d’anatomopathologie et de virologie du CHU de Fort-de-France.
L’extraction d’ADN a été réalisée à partir d’un minimum de 2 ml de prélèvement en milieu liquide. Ensuite, l’amplification a été réalisée par PCR. Un kit permettant la détection qualitative et le génotypage par biologie moléculaire (PCR) a été utilisé. Ce kit permettait de discriminer au minimum une vingtaine de génotypes, dont les génotypes HR16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 et des génotypes potentiellement oncogènes 53, 66, 70, 73, 82. Il permettait également de repérer les infections multiples.
Une analyse cytologique sur phase liquide a été réalisée sur l’ensemble des frottis.
Les résultats des examens cytologiques et virologiques ont été transmis aux gynécologues concernés pour le suivi des patientes. Dans le cas d’un prélèvement HPV positif avec une cytologie négative, un suivi gynécologique a été proposé à la patiente pour vérifier la disparition des HPV ou l’apparition de lésions cytologiques.
Dans le cas d’un prélèvement HPV positif avec une cytologie positive, une colposcopie était proposée à la patiente.
Aspects éthiques et réglementaires
Les examens étaient gratuits. Un avis éthique favorable a été donné par le Comité d’évaluation éthique de l’Inserm (CEEI) le 13 mars 2012 (Avis n° 12-064). Le projet a également reçu un avis favorable du Comité consultatif sur le traitement de l’information en matière de recherche dans le domaine de la santé (CCTIRS) le 13 juin 2012 et de la Commission nationale de l’informatique et des libertés (Cnil) le 4 octobre 2012.
Analyses
La prévalence standardisée de l’infection à HPV a été obtenue en utilisant la méthode de la standardisation directe avec la population mondiale comme population de référence.
Une régression logistique a été utilisée pour déterminer les variables associées à un test HPV positif. Des analyses par groupes d’âge ont été réalisées.
Les analyses statistiques ont été réalisées avec le logiciel Stata13® (College Station, Texas, États-Unis). La cartographie des données a été réalisée avec le logiciel Mapinfo 12.0® (Troy, NY, États-Unis). Le seuil de significativité retenu pour les tests statistiques était p<0,05.
Résultats
L’effectif de la population cible a été estimé à 6 921 femmes, sur la base des données de l’Insee de 2011.
Au total, 643 femmes ont été incluses (406 sur le Maroni et 237 sur l’Oyapock) ; 51 femmes n’ont pu être incluses car elles présentaient des critères de non-inclusion.
Le taux d’exhaustivité (ratio entre le nombre de femmes incluses et la population estimée des femmes de 20 à 65 ans dans chaque village) allait de 6% à Grand Santi à 41,7% à Camopi.
Le taux d’exhaustivité global était de 9,3%. La commune de Camopi était celle ou l’exhaustivité était la meilleure (41,7%). Cette commune n’a pas été incluse dans la comparaison entre les populations recensées et les populations incluses car les catégories d’âge différaient d’avec les autres communes, rendant l’agrégation impossible. Le tableau 1 montre, pour le Maroni et l’Oyapock (excluant Camopi), la structure de la population de femmes selon le recensement de 2008 et les effectifs inclus dans l’étude. Il existait une légère sur-représentation des catégories d’âge de plus de 35 ans et une sous-représentation des femmes de moins de 35 ans (p<0,01).
 Agrandir l'image
Agrandir l'imageL’entrée dans la vie sexuelle était précoce, avec 18,7% des femmes incluses ayant eu leur premier rapport sexuel avant 15 ans et plus de la moitié avant 17 ans. Chez les femmes de langue maternelle Bushinengue tongo, 29,4% avaient eu un rapport avant 15 ans ; ce pourcentage était de 31,3% chez les femmes de langue maternelle amérindienne et de 22% chez les femmes de langue maternelle portugaise.
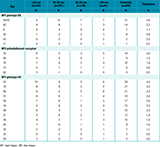
Le tableau 2 montre une prévalence HPV très élevée (33,3%), notamment pour les HPV à haut risque oncogène (23,3%). La prévalence HPV standardisée sur l’âge était de 35% pour tous les HPV et de 24,7% pour les HPV à haut risque.
Le fait d’avoir comme langue maternelle une des langues bushinenguées ou amérindienne semblait associé à une prévalence HPV non significativement plus élevée, alors que la langue portugaise était associée à une prévalence HPV plus faible (36,1% et 34% vs 26,3%, respectivement, p=0,06).
Les autres facteurs de risque tels que le nombre de partenaires sexuels au cours des 12 derniers mois (p=0,5), le nombre d’enfants (p=0,3), l’âge au premier rapport sexuel (p=0,5), le niveau d’études (p=0,4), la contraception (p=0,6) ou le fait d’être fumeuse (p=0,9) n’étaient pas significativement associés à des différences de prévalence de l’HPV.
Aucune femme incluse dans cette étude n’a déclaré avoir eu une vaccination contre l’infection à l’HPV. Parmi les femmes incluses, 20% n’avaient jamais eu de frottis auparavant, 35% plus de 3 ans auparavant ; 42% en avaient eu un moins de 3 ans auparavant, le délai était inconnu pour 3% des femmes. L’absence de frottis antérieur concernait 35% des femmes de 20 à 29 ans, 24% des 30-39 ans, 23% des 40-49 ans et 18% des plus de 50 ans.
 Agrandir l'image
Agrandir l'imageLes courbes de prévalence HPV par âge et de prévalence HPV à haut risque par âge présentaient toutes les deux une forme en U : les femmes de plus de 50 ans étaient les plus à risque d’être infectées par l’HPV, suivies par les femmes âgées de 20 à 29 ans (tableau 2) (p global=0,007 et 0,03, respectivement).
La prévalence de l’infection à HPV n’était pas significativement différente entre le bassin de l’Oyapock (34,2%) et le bassin du Maroni (32,8%) (p=0,6). Ce taux variait également selon la commune d’inclusion : la commune de Maripasoula était celle où la prévalence était la plus faible (23,1%). À l’inverse, les communes d’Apatou (38,5%), de Camopi (38,8%) et de Papaïchton (40,7%) étaient celles où la prévalence de l’infection HPV était la plus élevée (figure). Cette différence persistait lorsque l’on ajustait sur l’âge, en prenant Maripasoula comme groupe de référence ; Papaïchton et Trois Sauts avaient significativement plus de frottis positifs pour HPV (p=0,04 et p=0,01, respectivement).
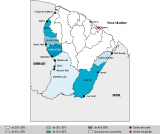 Agrandir l'image
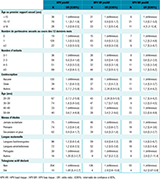
Agrandir l'imageLe tableau 3 montre que le génotype 52 était le plus fréquent des génotypes HPV à haut risque oncogène, avec un taux de prévalence de 4,5%. Le génotype 16 était le second génotype à haut risque le plus fréquent chez les femmes âgées de moins de 40 ans. Il semblait être moins fréquent chez les femmes de plus de 40 ans.
Parmi l’ensemble des femmes prélevées, la prévalence cumulée des génotypes 16 et 18 était supérieure à 5%, avec respectivement 3,3% et 2,3% de prévalence.
 Agrandir l'image
Agrandir l'imageLe tableau 4 présente les résultats d’une régression logistique qui montre qu’à part la tranche d’âge, aucune autre variable n’était significativement associée à un test HPV positif.
 Agrandir l'image
Agrandir l'imageLe tableau 5 montre que plus d’un quart des femmes présentant une cytologie normale avaient un test HPV positif (27,2%). Par ailleurs 26,1% des femmes HPV+ avaient un frottis normal. Parmi les 643 femmes incluses, 61 avaient au moins une anomalie cytologique et 90% des femmes présentant une anomalie cytologique avaient un test HPV positif, dont 87% avec au moins un génotype à haut risque oncogène. Les génotypes à haut risque oncogène les plus fréquemment retrouvés parmi les femmes ayant au moins une anomalie cytologique étaient HPV52 (23%), HPV58 (18%) et HPV16 (15%). Au total, 1,16% (IC95%:[0,47%-2,4%]) des femmes ayant un frottis interprétable avaient des lésions de haut grade type HSIL. Parmi celles ayant des HPV HR, 6% (IC95%:[2,5%-12,1%]) avaient des HPV HISL.
Les génotypes potentiellement oncogènes retrouvés chez les femmes ayant un frottis normal n’étaient pas les mêmes : HPV53 était le plus souvent retrouvé (3,5%) suivi par les HPV à haut risque 68 (3,3%) et l’HPV52 (2,6%).
 Agrandir l'image
Agrandir l'imageDiscussion
La prévalence globale standardisée de l’infection à HPV dans les communes isolées du Maroni et de l’Oyapock était largement supérieure à celle observée en France métropolitaine. De plus, le taux standardisé de prévalence était comparable 12, voire supérieur, à celui observé dans les études publiées à travers monde 13. Ce niveau de prévalence est habituellement observé dans des pays en développement. Ces taux élevés de prévalence sont en cohérence avec les taux d’incidence très élevés de cancer du col de l’utérus en Guyane, qui sont aussi plus proches de ce que l’on observe dans les pays en développement plutôt qu’en France métropolitaine. Ainsi, la prévalence standardisée des virus à haut risque chez les femmes ayant un frottis normal était deux fois plus élevée dans ces régions de Guyane (24,7%) qu’en France (13,7%) 14, p<0,001. Comme cela avait déjà été montré, l’âge aux premiers rapports sexuels était inférieur à celui observé en métropole 15.
Comme observé en Amérique latine et en Afrique, la prévalence par âge évoluait avec un aspect en U 16,17. Cette ré-augmentation du taux de prévalence chez les femmes plus âgées pourrait correspondre à de nouvelles infections liées à des changements de partenaires sexuels ou bien à un ralentissement de la clairance du virus décrite chez les femmes multipares 18. Cela souligne l’intérêt de dépister les femmes de plus de 50 ans. Comme dans de nombreuses autres études, les facteurs prédictifs de positivité HPV étaient relativement peu nombreux 18,19 ; en l’occurrence, ici seul l’âge était significativement lié à la prévalence.
Les limites de l’étude étaient le fait que les inclusions étaient volontaires, donc sujettes à un éventuel biais de sélection. Par ailleurs, les femmes vivant le plus loin des centres de santé étaient peut-être moins à même d’être incluses que celles vivant plus près de ces centres. Malgré ces limites méthodologiques, cette étude est la première réalisée dans ce territoire complexe où persistent des inégalités de santé importantes.
La politique de dépistage du cancer du col en France comprend frottis et, dans certaines conditions, test HPV. En dépit des études montrant l’intérêt des tests HPV par rapport à la cytologie classique, ces tests ne sont remboursés en France que lorsqu’il existe des anomalies cytologiques. L’incidence élevée du cancer du col en Guyane, ainsi que les résultats de notre étude sur les fleuves frontaliers de Guyane, suggèrent que le test HPV pourrait être une meilleure option que le frottis cervico-vaginal, qui était négatif dans 26,1% des infections HPV. Le test HPV peut également être fait sous forme d’autotest, ce qui pourrait augmenter son acceptabilité 20 et être moins contraignant en termes de ressources humaines. L’accent devrait aussi être porté sur l’amélioration de la couverture vaccinale et sur des interventions de dépistage innovantes 21,22. Le taux de couverture vaccinale contre le HPV dans les communes isolées de Guyane est inconnu, mais il est probablement proche de zéro. Aucune des femmes interrogées ne déclarait avoir été vaccinée. La diversité des génotypes circulants suggère enfin que le vaccin nonavalent serait sans doute plus adapté à la Guyane que les vaccins bi ou tétravalents qui ne couvrent pas plusieurs des génotypes circulants potentiellement oncogènes 23. En effet, HPV16 n’était pas le plus fréquemment retrouvé, HPV52 ou 58 étant plus fréquents.
Près de 10% des femmes avaient des anomalies cytologiques, ce qui est le double de ce qui a été observé dans l’état d’Amazonas au Brésil 12. Parmi toutes les femmes ayant un frottis interprétable, 1,2% avaient des HSIL, ce qui est 4 fois supérieur à ce qui était observé en Île-de-France en 2002 (0,3%) 24 et qui est supérieur aux 0,7% observés chez des populations amérindiennes dans l’état d’Amazonas au Brésil 12. Si l’on considère la proportion de patientes ayant des anomalies cytologiques par génotype d’HPV, on retrouvait les HPV 52, 58 et 16. L’espèce 9, qui comporte les génotypes HPV16, 31, 33, 35, 52, 58, 67, était la plus fréquemment associée à des anomalies cytologiques. Cinq de ces génotypes (HPV16, 31, 33, 52 et 58) sont retrouvés dans le vaccin nonavalent. Ce vaccin nonavalent a d’ailleurs été recommandé en France et en Guyane et sa valeur ajoutée pourrait être encore plus forte 25. Cependant, aujourd’hui, une forte proportion de la population vivant sur les fleuves n’a pas de couverture sociale et ses ressources financières sont limitées. Les coûts restant à la charge des familles restent donc prohibitifs et sont sans doute un obstacle majeur à une couverture vaccinale correcte. Étant donné à la fois les résultats de l’enquête, l’incidence du cancer du col en Guyane et le retard aux soins chez les personnes les plus démunies, il semble capital que les autorités de santé prennent en considération ces freins économiques et structuraux pour que ces populations particulièrement concernées puissent avoir accès à la vaccination et à un dépistage de bonne qualité.
En conclusion, cette étude a montré que près d’un tiers des femmes étaient infectées par le HPV et que plus du quart de celles ayant des HPV oncogènes avaient un frottis normal. Au vu de l’incidence élevée du cancer du col en Guyane et d’un fréquent retard diagnostique 26,27, ces résultats soulignent l’importance de la vaccination, de préférence avec un vaccin nonavalent, et d’un dépistage étendu à l’aide de tests HPV plus sensibles que les frottis et qui, de surcroît, ont un potentiel de simplification opérationnelle non négligeable dans des territoires où les ressources de santé sont rares 20,28,29. Enfin, bien que les solutions techniques existent, l’accès à la prévention primaire reste pour l’instant théorique dans cette région où la majorité des personnes ne peuvent supporter le coût du vaccin contre le HPV.
Remerciements
Nous remercions les personnels des centres délocalisés de prévention et de soins pour leur aide.
Cette étude a été co-financée par les Fonds européens de développement régional (numéro présage FEDER : 30 814).




