Bilan de l’épidémie à virus Zika survenue en Polynésie française entre octobre 2013 et mars 2014. De la description de l’épidémie aux connaissances acquises après l’évènement
// Assessment of the Zika virus outbreak in French Polynesia between October 2013 and March 2014. From the description of the outbreak to knowledge gained subsequently
Résumé
Dans le contexte actuel d’émergence globale du virus Zika, nous rapportons les données épidémio-cliniques de l’épidémie survenue en Polynésie française (région Pacifique) entre octobre 2013 et mars 2014.
Les données de surveillance sentinelle syndromique, utilisant une définition de cas originale, couplées au diagnostic par biologie moléculaire ont permis la surveillance de l’épidémie et la description des cas cliniques confirmés.
Les premiers clusters de « syndromes éruptifs » ont été détectés début octobre 2013 et l’identification du virus Zika a été faite par l’Institut Louis Malardé le 30 octobre 2013. Durant les six mois d’épidémie, il a été estimé qu’un total de 32 000 cas suspects avait consulté (11,5% de la population), avec un pic atteint dès la 8e semaine. Les signes cliniques les plus fréquemment rapportés pour les 297 cas confirmés et investigués étaient : éruption maculo-papuleuse (93%), asthénie (78%), fièvre ressentie (72%), arthralgies (65%), hyperhémie conjonctivale (63%). La durée moyenne de l’épisode aigu était de six jours. Des complications neurologiques ou auto-immunes suspectées d’être liées à l’infection par le virus Zika ont été observées pendant l’épidémie. En particulier, 42 cas de syndromes de Guillain-Barré ont été décrits, pour lesquels le lien de causalité a été prouvé a posteriori.
Cette épidémie a été la première épidémie de Zika d’importance décrite de manière exhaustive et à l’origine de formes sévères. La souche de virus Zika qui a émergé en Polynésie française a gagné en 2014 le reste du Pacifique et est probablement celle qui circule dans les Amériques depuis 2015.
Abstract
In the current context of the global epidemic caused by Zika virus, we report the epidemiological and clinical features of the outbreak in French Polynesia (Pacific region) between October 2013 and March 2014.
The syndromic sentinel surveillance data using an original case definition coupled with diagnosis by molecular biology have allowed the monitoring of the outbreak and the description of confirmed clinical cases.
The first clusters of “exanthematous illness” were detected in early October 2013 and biological confirmation of Zika virus was performed by the Institute Louis Malardé on 30 October 2013. During the 6 months of the outbreak, a total of 32,000 consulting suspected cases was estimated (11.5% of the population), with a peak reached during the 8th week. The most commonly reported clinical signs for 297 investigated confirmed cases were: maculopapular rash (93%), asthenia (78%), experienced fever (72%), arthralgia (65%), conjunctival hyperemia (63%). The mean duration of the acute episode was 6 days. Cases of neurologic or autoimmune complications suspected to be related to Zika virus infection were observed. In particular, 42 cases of Guillain-Barré syndrome were described, for which the causal link was proven thereafter.
This outbreak was the first Zika outbreak comprehensively described in importance worldwide, with reported severe complications. The Zika virus strain that emerged in French Polynesia subsequently extended in 2014 to other Pacific countries and is probably the strain that has been spreading in the Americas since 2015.
Introduction
Le virus Zika (ZIKV) est un arbovirus de la famille des Flaviviridae et du genre Flavivirus 1, génétiquement proche du virus de la dengue et transmis par les moustiques du genre Aedes. Depuis sa découverte en 1947 2, sa circulation avait été décrite de façon sporadique en Afrique et en Asie 3, avec seulement 14 infections humaines confirmées avant 2007, année de la première épidémie décrite à Yap, dans le Pacifique 4. Les trois quarts de la population auraient été infectés mais seuls 20% des cas avaient présenté des signes cliniques, toujours bénins. La seconde épidémie a été déclarée en Polynésie française (Pf) en 2013 5 puis le virus a diffusé dans le Pacifique 6,7. En 2015, le ZIKV a émergé au Brésil 8 avant de gagner les Amériques et les Antilles. Entre le 1er janvier 2016 et le 13 avril 2016, la circulation du ZIKV a été rapportée dans 64 pays et territoires 9. Le lien entre le ZIKV et des complications neurologiques observées lors de ces différentes épidémies (syndromes de Guillain-Barré (SGB) essentiellement) 10 ainsi que des anomalies graves chez les nouveau-nés (microcéphalie principalement) 11,12 a été démontré, de même que le tropisme de ce virus pour les cellules nerveuses, observé sur des cellules en culture 13.
Le principal mode de transmission du ZIKV est vectoriel, par piqûre de moustiques infectés 3. Une transmission interhumaine par voie materno-fœtale 11,14 et sexuelle 15 a également été démontrée et le risque transfusionnel a été établi 16,17. Le diagnostic de l’infection à ZIKV repose essentiellement sur la détection de l’ARN viral par biologie moléculaire (Reverse Transcription PCR ou RT-PCR) dans le sang 3,18, la salive 19 et les urines 20. Le ZIKV a aussi été isolé dans le liquide amniotique, le placenta et l’encéphale de nouveau-nés atteints de microcéphalies et autopsiés 21. Le diagnostic sérologique est d’interprétation difficile en raison des importantes réactions croisées avec les autres Flavivirus (principalement le virus de la dengue) 18.
Cet article rapporte les principaux aspects cliniques et épidémiologiques liés à l’épidémie due au ZIKV survenue en Pf entre octobre 2013 et mars 2014, qu’ils aient été décrits au décours de l’épidémie ou dans le cadre d’études réalisées a posteriori, et ce jusqu’à mai 2016.
Méthodes
La Pf bénéficie d’un dispositif de surveillance coordonné par le Bureau de veille sanitaire (BVS) de la Direction de la santé, utilisant à la fois des données de déclaration de cas, des données de laboratoire et les données agrégées d’un système de surveillance syndromique reposant sur un réseau de médecins sentinelles et les services d’urgences hospitalières 22. Quatre syndromes sont suivis en routine : les syndromes « grippaux », les syndromes « dengue-like » (la Pf étant une zone d’endémie de dengue), les syndromes diarrhéiques et les « fièvres isolées de plus de trois jours ».
Afin de suivre l’évolution de l’épidémie due au ZIKV, la surveillance syndromique spécifique a été renforcée dès la survenue des premiers cas et une définition de cas a été établie et diffusée localement dès le 30 octobre 2013. Un cas suspect était défini par une éruption maculo-papuleuse érythémateuse ou une fièvre mesurée ou rapportée <38,5°C, associée à au moins deux signes parmi les suivants : hyperhémie conjonctivale (yeux rouges), arthralgies ou myalgies, œdèmes des mains ou des pieds. Un cas confirmé était un cas suspect avec détection du virus par biologie moléculaire (RT-PCR) dans le sang ou la salive (les urines n’étaient pas testées en routine).
Durant l’épidémie, une moyenne de 45 sites sentinelles [extrêmes : 24-56], répartis sur l’ensemble des cinq archipels de la Pf, ont rapporté chaque semaine le nombre de cas suspects vus en consultation. Le nombre de consultants pour suspicion d’infection à ZIKV a ensuite été extrapolé à l’ensemble du territoire à partir du nombre total de sites médicaux, en pondérant selon leur niveau d’activité habituel.
Le diagnostic par biologie moléculaire a été mis en place dès le 20 novembre à l’Institut Louis Malardé (ILM). En raison des possibles réactions croisées avec le virus de la dengue, le diagnostic sérologique n’a pas été utilisé durant l’épidémie. Des prélèvements ont été réalisés sur prescription médicale pour les cas suspects, sans échantillonnage aléatoire. Les cliniciens renseignaient un questionnaire clinique pour tout prélèvement envoyé à l’ILM. Les cas confirmés étaient recontactés par téléphone par le BVS pour leur suivi.
Les cliniciens hospitaliers ont été sensibilisés pour signaler au BVS les éventuelles formes atypiques ou complications suspectées. Des investigations complémentaires ont par la suite été menées quand cela était possible. Tous les cas de SGB diagnostiqués ont fait l’objet d’une investigation.
Résultats
Surveillance de l’épidémie
Début octobre 2013, alors qu’une épidémie de dengue (sérotypes 1 et 3) était en cours en Pf 5,23, des clusters de cas de syndromes éruptifs subfébriles ont été signalés par plusieurs médecins, d’abord à Tahiti puis rapidement dans d’autres archipels de Pf 5. Les cas étaient décrits comme des épisodes modérément fébriles, souvent accompagnés d’éruption, mais spontanément résolutifs en 3 à 7 jours. Aucun signe de gravité n’était rapporté ; les hommes et les femmes ainsi que toutes les tranches d’âge étaient indifféremment touchés. Plus de 600 cas ont été ainsi rapportés en moins de trois semaines. Un appel à la surveillance a été lancé par le BVS à tous les médecins de Pf et des prélèvements sanguins ont été envoyés à l’ILM pour investigation biologique. Les recherches d’ARN viral de dengue et de chikungunya étaient négatives. Le 30 octobre 2013, de façon concomitante aux investigations épidémiologiques, le Pôle de recherche et de veille sur les maladies infectieuses émergentes de l’ILM identifiait le ZIKV dans le prélèvement sanguin de 3 patients. Le virus a été amplifié par RT-PCR et l’identification confirmée par séquençage 5.
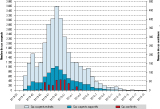
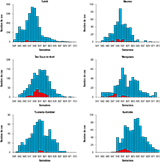
Durant l’épidémie, 8 750 cas suspects ont été rapportés par le réseau sentinelle. Parmi les 1 067 prélèvements réalisés pour 885 patients testés par RT-PCR ZIKV, 383 cas (52%) se sont révélés positifs : 210 sur prélèvements sanguins (taux de positivité de 28,1%) et 182 sur prélèvements salivaires (taux de positivité de 57,1%) 19. Par extrapolation à l’ensemble des médecins et infirmiers consultants, un total de 32 000 cas suspects ayant consulté a été estimé pour l’ensemble du territoire, soit 11,5% de la population (figure 1). La diffusion de l’épidémie a été extrêmement rapide, avec un pic atteint dès la 8e semaine à Tahiti et à la 9e semaine pour l’ensemble de la Pf. L’archipel des Australes (le plus isolé) a été touché le plus tardivement. La proportion de cas suspects consultants rapportée à la population locale variait de 10% à 40% selon les archipels (figure 2).
 Agrandir l'image
Agrandir l'image
 Agrandir l'image
Agrandir l'image
Sur les 383 cas confirmés, 297 ont pu être investigués. Ils résidaient aux Îles-du-Vent (128), aux Îles-Sous-le Vent (124), aux Australes (21), aux Marquises (21) et aux Tuamotu (3). Il s’agissait de femmes dans 201 cas, d’hommes dans 96 cas ; l’âge moyen était de 27,8 ans (médiane : 28 ans, extrêmes : 0-74 ans). Parmi les 303 cas confirmés testés également pour le virus de la dengue, trois co-infections avec le ZIKV ont été décrites (une dengue non typée, une dengue sérotype 1 et une dengue sérotype 3).
Infections à ZIKV en phase aiguë
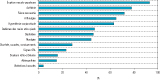
Les symptômes les plus fréquents étaient : une éruption maculo-papuleuse (93%), une asthénie (78%), une fièvre ressentie (72%), des arthralgies (65%), une hyperhémie conjonctivale (63%), des œdèmes des pieds ou des mains (47%), des céphalées (46%), des myalgies (44%). Des signes digestifs ou de la sphère ORL ont également été décrits (figure 3). Les arthralgies étaient localisées aux mains (30% des cas), aux pieds (17%), aux genoux (16%), aux doigts (10%) et aux poignets (10%). L’asthénie, la fièvre et les céphalées étaient les signes les plus précoces (1,3 jour), alors que l’apparition des œdèmes était plus tardive (2,4 jours). Les symptômes persistants le plus longtemps étaient l’éruption cutanée (5,2 jours) et les arthralgies (6,8 jours). Les œdèmes étaient plus fréquents chez les femmes que chez les hommes (52% vs 38%, p=0,03), ainsi que le prurit (52% vs 43%, p=0,01). La fréquence de survenue des œdèmes, des arthralgies et de l’hyperhémie conjonctivale tendait à augmenter avec l’âge du patient. La durée totale moyenne de l’épisode aigu était de 6 jours (médiane : 6 jours, extrêmes : 2-17 jours). Certains symptômes pouvaient persister jusqu’à 3 semaines (éruption, asthénie, arthralgies…). Par ailleurs, les bilans biologiques de routine n’ont pas montré d’anomalies biologiques sévères telles que celles rencontrées lors de la dengue (notamment absence de thrombopénie sévère) 24. Aucun patient n’a présenté de signes de gravité ni nécessité d’hospitalisation lors de l’épisode aigu, les formes compliquées ou sévères étant survenues à distance de l’infection initiale.
 Agrandir l'image
Agrandir l'image
Complications à distance des infections à ZIKV
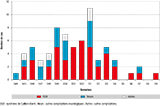
Entre début novembre 2013 et début mars 2014, 69 complications neurologiques ou auto-immunes susceptibles d’être liées au ZIKV ont été identifiées. Parmi les complications neurologiques, 42 cas de SGB ont été diagnostiqués par les services du Centre hospitalier de Pf. D’autres cas de complications neurologiques ont été évoqués, au nombre de 21, dont 9 encéphalites et méningo-encéphalites, 4 myélites ainsi que d’autre atteintes neurologiques (paresthésies, paralysies faciales, vestibulite). De plus, 4 cas de purpura thrombopénique immunologique, 1 de névrite optique et 1 de papillite ont été rapportés (figure 4).
Les 42 cas de SGB sont survenus sur une période de 4 mois durant l’épidémie de Zika alors que la Pf en enregistre habituellement moins de 5 cas par an. Un lien de causalité entre les cas de SGB et le ZIKV a rapidement été évoqué du fait de la relation spatio-temporelle. Une étude cas-témoins rétrospective, réalisée entre 2014 et 2016, a permis de décrire les caractéristiques de ces patients et de démontrer le lien entre le ZIKV et l’augmentation du nombre de cas de SGB en Pf, des anticorps anti-ZIKV ayant été mis en évidence chez 98% d’entre eux 10.
Concernant les autres complications neurologiques, malgré une PCR ZIKV positive pour 4 cas et la détection d’anticorps (IgG) anti-ZIKV pour 6 autres, le lien de causalité n’a pas pu être établi.
 Agrandir l'image
Agrandir l'image
Transmission non vectorielle du ZIKV
Deux cas de transfusion materno-fœtale ont été décrits 14 ; le risque de transmission sexuelle a été évoqué suite à l’isolement du ZIKV dans le sperme d’un patient présentant une hémospermie 15 et le risque transfusionnel a été démontré suite au dépistage positif de donneurs de sang asymptomatiques au moment du don 25. Par ailleurs, une augmentation du nombre de cas de malformations neurologiques congénitales issues de grossesses survenues lors de l’épidémie a été décrite par la suite 26 et une association entre les 8 cas de microcéphalie et l’infection à ZIKV a été montrée 12.
Discussion - conclusion
La détection précoce de l’épidémie et l’identification du ZIKV – virus jusqu’alors peu décrit, tant dans ses aspects cliniques ou biologiques qu’épidémiologiques - ont constitué une performance sur le plan de la surveillance. Le signalement des premiers syndromes, l’analyse épidémiologique, la confirmation virologique et la mise en place du diagnostic en routine ont été réalisés en moins d’un mois. Ceci a permis de valider un dispositif de surveillance et de détection des pathologies émergentes reposant sur une collaboration entre les différents établissements et services de santé de Pf. L’origine de l’épidémie n’a pu être déterminée, même si l’analyse génomique a pu confirmer que la souche de ZIKV ayant circulé en Pf appartenait à la lignée asiatique 5.
Cette épidémie, survenue en Pf en 2013-2014 avec plus de 32 000 cas symptomatiques consultants estimés, a été la première grande épidémie due au ZIKV dans le monde. La très grande majorité des patients a présenté des signes cliniques mineurs. Le tableau clinique des formes aiguës a pu être précisé pour 297 cas, relevant la fréquence de l’éruption cutanée (93%) mais aussi d’une composante articulaire, avec persistance possible des signes jusqu’à trois semaines après l’épisode aigu. Ces caractéristiques ont aussi été décrites lors de l’épidémie de Zika survenue au Brésil en 2015 27. Des formes graves, liées à l’infection à ZIKV ont été décrites pour la première fois, en particulier des atteintes neurologiques. Les SGB ont représenté la complication la plus fréquente en Pf, comme par la suite en Amérique latine et aux Caraïbes 9. Des cas de méningo-encéphalite et de myélite ont également été décrits récemment aux Antilles 28,29. La possibilité d’une transmission materno-fœtale 14 et le risque de transmission par voies sexuelle 15 et transfusionnelle 25 ont également été montrés lors de cette épidémie. Enfin, la survenue de malformations neurologiques congénitales, issues de grossesses exposées, dont des microcéphalies, et leur association avec l’infection à ZIKV ont pu être décrits a posteriori, début 2016 12,26. Ces complications avaient été signalées fin 2015, suite à l’émergence du ZIKV sur le continent américain 9.
La proportion estimée des consultants symptomatiques (11,5%) sous-estime la réalité de la contagion et le taux d’attaque final, car la plupart des personnes infectées, peu ou pas symptomatiques, n’ont pas consulté. Les résultats préliminaires d’une étude de séroprévalence ont montré que la moitié de la population avait acquis des anticorps anti-ZIKV 30. Un travail de modélisation récent estime même le taux d’attaque global à 94%, avec un taux de reproduction R0 compris entre 2,6 et 4,8 31.
Les raisons de l’émergence du virus en Pf sont inconnues, mais des conditions favorables comme l’absence d’immunité de la population avant l’introduction du virus et la présence d’au moins deux espèces de moustiques potentiellement vectrices (Aedes aegypti et Aedes polynesiensis) étaient présentes 3. La souche de ZIKV qui a émergé aux Amériques est très proche génétiquement de celle qui a circulé dans le Pacifique et principalement en Pf, laissant supposer une introduction au Brésil en provenance du Pacifique 32. Ces données, ainsi que les nombreux signalements de cas importés en Europe et aux États-Unis en provenance de la Pf et du Pacifique en général 6,32 soulignent que ces régions sont potentiellement des lieux d’émergence pour certaines arboviroses (Zika, dengue, chikungunya) et que la Pf est une porte d’entrée potentielle de ces pathologies pour les autres régions du monde, en particulier pour l’Europe et la France métropolitaine dans les zones où Aedes albopictus est implanté.
Remerciements
Les auteurs tiennent à remercier les équipes d’investigation et de veille de la Direction de la santé, l’équipe du laboratoire de l’Institut Louis Malardé, les praticiens du Centre hospitalier de la Polynésie française, les praticiens publics et libéraux et l’ensemble des membres du réseau sentinelle.




