Surveillance des gastro-entérites aiguës en collectivités pour personnes âgées. Bilan national de cinq saisons de surveillance hivernale (novembre 2010-mai 2015)
// Surveillance of acute gastroenteritis in long-term care facilities for elderly. National record on the monitoring of five winter seasons (November 2010 - May 2015)
Résumé
Les épisodes de gastro-entérites aiguës (GEA) sont fréquents dans les établissements pour personnes âgées. La forte promiscuité des résidents et personnels dans ces collectivités (fréquence des contacts et des soins, visiteurs), associée au risque de transmission interhumaine, favorise ces épidémies.
C’est dans ce contexte qu’un dispositif de surveillance spécifique des GEA a été mis en place en 2010 en France afin de permettre l’identification précoce des épisodes épidémiques, de promouvoir l’application immédiate des mesures de contrôle et de décrire les épisodes.
Cet article dresse le bilan des épidémies de GEA en collectivités pour personnes âgées en France métropolitaine pour cinq saisons de surveillance, de novembre 2010 à mai 2015.
Sur l’ensemble de la période, 3 549 épisodes de GEA (définis comme la survenue d’au moins 5 cas parmi les résidents de l’établissement) ont été déclarés dans 3 404 établissements ayant recensé 88 930 résidents malades. Le taux d’attaque parmi les résidents allait de 28% à 32% selon l’année. Le délai de signalement est passé d’une médiane de cinq jours pour les saisons 2010 à 2012 à une médiane de quatre jours pour les saisons 2012 à 2015. Une étiologie a été recherchée pour la moitié (48%) des épisodes déclarés, avec une identification de norovirus dans 65% à 81% de ces épisodes selon l’année. Pour 98% des épisodes, au moins une mesure de contrôle a été mise en place quelle que soit la saison. La plupart des mesures recommandées (renforcement de l’hygiène des mains, arrêt ou limitation des activités collectives pour les résidents malades…) ont été plus systématiquement appliquées au fil des années. Le taux d’attaque était significativement plus faible lorsque les mesures de contrôle étaient mises en place moins de trois jours après le début des signes du premier cas (IRR=0,90 ; p<0,001).
Ce dispositif est utile en termes de recensement précoce des épisodes et d’amélioration de la mise en place des mesures de gestion. Un renforcement des investigations (demande de confirmation biologique, envoi des prélèvements de selles au Centre national de référence des virus entériques) pourrait néanmoins être mis en place afin de permettre de mieux caractériser les virus circulants.
Abstract
Outbreaks of acute gastroenteritis (AGE) are frequent in long term care facilities for the elderly (LTCFE). The high promiscuity between residents and staff in these facilities (frequent contacts and care, visitors), together with the high risk of person-to-person transmission facilitate the spread of infections.
In this context, a specific surveillance system for gastrointestinal outbreaks in LTCFE was implemented in 2010 in mainland France. The objective of the system was the early notification of outbreaks in order to facilitate the rapid implementation of control measures, and describe the epidemiology of the outbreaks.
The present article provides an overview of AGE outbreaks among LTCFE residents in metropolitan France during five surveillance seasons, from November 2010 to May 2015.
Over the study period, a total of 3,549 AGE episodes (defined as the occurrence of at least five cases among LTCFE residents) were reported in 3,404 facilities, representing 88,930 cases of illness. The attack rate among residents ranged from 28% to 32% depending on the year. The median delay in notifying an outbreak decreased from five days for the 2010-2012 seasons to four days for the 2012-2015 seasons. Laboratory testing was performed in 1,694 episodes (48%), and norovirus was identified in 65% to 81% of these episodes, depending on the year. In 98% of them, at least one control measure was implemented, regardless of the season. Most recommended measures (improving hand hygiene, interruption or limitation of collective activities for sick patients, etc.) were applied more systematically over the years. The attack rate among residents was significantly lower when control measures were implemented within the three days following onset of symptoms of the first case (IRR=0.90; p<0.001).
This specific surveillance system is useful in terms of early identification of outbreaks and for improving control measures. The need to strengthen investigations (laboratory confirmation of outbreaks, addressing stool samples to the National Reference Laboratory for enteroviruses) could help improving the characterization of circulating viruses.
Introduction
Une épidémie de gastro-entérites aiguës (GEA) est observée tous les hivers en France comme dans d’autres pays 1,2. Les GEA sont surtout d’origine virale, principalement via une transmission de personne à personne ou, dans une moindre mesure, alimentaire 3,4. Elles se manifestent généralement par de la diarrhée et/ou des vomissements. La durée de la maladie est relativement brève, mais certaines complications, comme une déshydratation pouvant donner lieu à une hospitalisation, obligent les autorités sanitaires à rester en alerte.
Les épisodes de GEA sont fréquents dans les collectivités pour personnes âgées 5,6,7,8,9,10. La forte promiscuité dans ces établissements (fréquence des contacts et des soins, visiteurs), associée au risque de transmission interhumaine, favorise les épidémies. La détection précoce de ces épisodes et la mise en place rapide des mesures de contrôle permettent de limiter l’impact de l’épidémie sur les résidents et le personnel soignant 11.
Depuis 2010, une surveillance spécifique des GEA et des infections respiratoires aiguës (IRA) a été mise en place en France suite à la publication, la même année, de recommandations nationales relatives aux conduites à tenir devant des cas groupés de GEA et IRA dans les collectivités de personnes âgées, émises par le Haut Conseil de la santé publique 12. Ces recommandations ont été reprises dans une instruction de la Direction générale de la santé en 2012 13. La surveillance des GEA, animée par les Cellules d’intervention en région (Cire) de Santé publique France, les Agences régionales de santé (ARS) et les Antennes régionales de lutte contre les infections nosocomiales (Arlin), a été mise en place pour permettre l’identification précoce des épisodes épidémiques de GEA, promouvoir l’application immédiate des mesures de contrôle et décrire ces épisodes en termes de fréquence, caractéristiques et sévérité.
Cet article présente le bilan national de la surveillance des GEA en collectivités pour personnes âgées pour cinq saisons, de novembre 2010 à mai 2015.
Matériel-méthodes
Système de surveillance
La surveillance des GEA en collectivités pour personnes âgées (désignées par Ehpa – établissement d’hébergement pour personnes âgées – dans la suite de l’article) repose sur le signalement aux ARS, par les Établissements d’hébergement pour personnes âgées dépendantes (Ehpad), les Unités de soins de longue durée (USLD), les foyers de logements pour personnes âgées et les maisons de retraite hors Ehpad, de tout épisode de GEA dans leur établissement. Un épisode est défini par la survenue d’au moins cinq cas de GEA : apparition soudaine de diarrhée (au moins deux selles de consistance molle ou liquide de plus que ce qui est considéré comme normal pour le résident, au cours d’une période de 24 heures), ou apparition soudaine d’au moins deux accès de vomissements au cours d’une période de 24 heures) parmi les résidents, dans un délai de quatre jours.
Les données de signalement sont recueillies par les établissements à l’aide de fiches standardisées envoyées aux ARS. Après validation par l’ARS, les données des signalements reçus sont saisies dans une application dédiée (VoozEhpad) de Santé publique France.
Lors de la survenue d’épisodes de GEA, dont l’épidémiologie et la symptomatologie suggèrent une origine virale, une recherche de virus dans les selles peut être effectuée au niveau local et/ou par le Centre national de référence des virus entériques (CNR) à Dijon pour recherche et caractérisation du virus.
Un groupe de travail de pratiques professionnelles (GEPP) sur la surveillance des IRA et des GEA en Ehpa a été mis en place en avril 2013 à Santé publique France, pour confronter les méthodes et les résultats des équipes dans les différentes régions et avec pour objectif d’améliorer les travaux et collaborations engagés sur cette thématique. Les programmes d’analyse développés par ce groupe ont été utilisés dans cet article.
Données de surveillance
Période d’analyse
Une saison de surveillance a été définie comme la période de signalement comprise entre le 1er novembre et le 31 mai de l’année suivante.
Données collectées
La fiche de signalement permet le recueil de données concernant l’établissement (adresse, type, nombre de résidents, nombre de personnels), l’épisode concerné (date de signalement, date du premier et dernier cas, nombre de résidents et de personnels malades, hospitalisés ou décédés, signes cliniques, durée des symptômes, recherche et résultats biologiques) et les mesures de contrôle mises en place (type d’investigation, type de mesures mises en place, précisions sur une demande d’appui extérieur, date de mise en place).
Il est demandé aux établissements d’envoyer un bilan à l’ARS à la fin de chaque épisode (nombre final de personnes malades, hospitalisées et décédées, mesures qui ont été mises en place…) pour pouvoir le clôturer et disposer de données définitives concernant chacun.
Critères d’inclusion et d’exclusion
Tous les épisodes de GEA signalés durant la période de surveillance par un établissement prenant en charge des personnes âgées, répondant à la définition d’un épisode de GEA et clôturés à la fin de l’épisode, ont été inclus.
Pour les épisodes non clôturés, mais pour lesquels le délai de signalement était supérieur à huit jours, les données ont été considérées comme suffisamment complètes et proches d’un bilan final pour être prises en compte dans l’analyse (2 à 3% des épisodes déclarés selon l’année).
Ont finalement été exclus tous les épisodes :
- non clôturés à la fin de la saison et avec un délai de signalement inférieur à 8 jours (6 à 9% des épisodes déclarés selon l’année) ;
- ou signalés avec moins de 5 malades (0,7 à 3% des épisodes déclarés) ;
- ou signalés dans des établissements ne prenant pas en charge des personnes âgées (2 à 3% des épisodes déclarés).
Indicateurs étudiés
La durée de l’épisode est la différence entre les dates des premiers symptômes du dernier cas et du premier cas au sein de l’établissement.
Le délai de signalement est la différence entre la date de signalement et celle des premiers symptômes du premier cas.
Le délai pour la mise en place des mesures de contrôle est la différence entre la date de mise en place des premières mesures de contrôle et celle de début des signes du premier cas.
Le taux d’attaque est le rapport entre le nombre total de résidents malades (respectivement de personnels malades) et le nombre total de résidents (respectivement de personnels) dans les établissements pour lesquels ces deux informations étaient disponibles.
Le taux d’hospitalisation est le rapport entre le nombre de résidents hospitalisés (ou respectivement les personnels hospitalisés) et le nombre de résidents malades (ou respectivement les personnels malades).
La létalité est le rapport entre le nombre de résidents décédés (ou personnels décédés) et le nombre de résidents (ou personnels) malades.
Le taux de signalement est le nombre d’épisodes déclarés divisé par le nombre d’établissements prenant en charge des personnes âgées (Ehpad, USLD, foyers-logement recensés en métropole à partir des données issues du répertoire national des établissements sanitaires et sociaux 14 (Données Finess des établissements pour personnes âgées de 2011 à 2014).
Un épisode identifié pour une étiologie donnée est défini lorsqu’au moins une analyse de selles était positive pour cette étiologie. Le nombre de malades ayant eu un prélèvement de selles, qu’il soit positif ou négatif, n’est pas disponible.
Les signes cliniques (diarrhée, vomissements, fièvre) pour un épisode donné ont été rapportés lorsque plus de la moitié des malades (résidents et personnels) présentaient les symptômes mentionnés.
Analyses statistiques
Le Chi2 de tendance a été utilisé pour comparer des proportions.
Les facteurs associés au taux d’attaque ont été étudiés à l’aide d’une régression binomiale négative afin de tenir compte de la surdispersion présente dans les données. Les variables significativement associées en analyse univariée (p<0,20) ont été incluses dans le modèle final. L’analyse multivariée sur le taux d’attaque a été ajustée sur la saison de surveillance, la région et la taille de l’établissement. La durée de l’épisode étant une variable continue, elle a été testée et modélisée par des polynômes fractionnaires 15.
Les analyses ont été réalisées avec le logiciel Stata®12.1 (Stata Corporation, College Station, Texas, États-Unis), le seuil de significativité étant fixé à 5%.
Résultats
Caractéristiques des épisodes par saison de surveillance
Pour les cinq saisons de surveillance, 3 549 épisodes ont été déclarés dans 3 404 établissements (93% d’Ehpad, 1% d’USLD et 6% d’autres établissements incluant des maisons de retraites non Ehpad et des foyers logements), totalisant 88 930 résidents malades et 17 758 personnels malades (tableau 1). Pour la saison 2010-2011, le taux de signalement était de 5 épisodes pour 100 établissements ; il était de 5,8 pour la saison 2011-2012, de 11,5 pour 2012-2013, de 5,5 pour 2013-2014 et de 8,2 pour la saison 2014-2015.
Le délai de signalement est passé d’une médiane de 5 jours pour les saisons 2010-2011 (étendue : 0-94) et 2011-2012 (étendue : 0-67) à une médiane de 4 jours pour les saisons 2012-2013 (étendue : 0-92), 2013-2014 (étendue : 0-54) et 2014-2015 (étendue : 0-77).
La plupart des établissements n’ont déclaré qu’un seul épisode de GEA sur les cinq saisons de surveillance (87% des établissements en 2010-2011 ; 91% en 2011-2012 ; 96% en 2012-2013 et 2013-2014 ; 94% en 2014-2015). Pour les saisons 2010-2011 et 2012-2013, jusqu’à 5 épisodes ont pu être déclarés par un même établissement.
 Agrandir l'image
Agrandir l'image
Plus de la moitié des signalements a été effectuée entre janvier et février, avec un nombre d’épisodes déclarés plus élevé en semaine 1 pour la saison 2010-2011, en semaine 2 pour 2012-2013, 2013-2014 et 2014-2015 et en semaine 4 pour 2011-2012 (figure 1).
 Agrandir l'image
Agrandir l'image
Répartition géographique des signalements
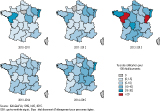
Pour les cinq saisons, les taux de signalement étaient plus élevés dans les régions de l’Est et de l’Ouest (figure 2).
Le taux de signalement était plus élevé pour les régions Pays de la Loire (entre 9,6% des établissements en 2013-2014 et 22,9% en 2012-2013), Alsace (entre 8,5% en 2013-2014 et 18,8% en 2010-2011), Franche-Comté (entre 3,6% en 2010-2011 et 16,3% en 2012-2013) et Bretagne (entre 1,6% en 2010-2011 et 17,2% en 2012-2013).
 Agrandir l'image
Agrandir l'image
Signes cliniques (tableau 2)
Dans plus de 90% des épisodes, une diarrhée a été rapportée chez au moins 50% des malades. Des vomissements ont été signalés dans 60% des épisodes chez au moins 50% des malades. Pendant les saisons 2010-2011 et 2011-2012, pour 18 à 20% des épisodes, une fièvre mesurée était signalée chez 50% des malades. À partir de la saison 2012-2013 cette proportion diminuait à 8%. La durée médiane des signes cliniques était de 2 jours, quelle que soit la saison.
 Agrandir l'image
Agrandir l'image
Investigations et mesures de contrôle
Recherche étiologique
Une étiologie a été recherchée dans près de la moitié (48%) des épisodes déclarés sur la période d’étude. Cette proportion a néanmoins diminué sur la période, passant de 57% en 2010-2011 à 43% en 2014-2015 (p<0,005).
Entre 41% (saison 2013-2014) et 49% (saison 2011-2012) de ces recherches ont abouti à l’identification d’au moins un agent chez au moins un cas.
Une étiologie à norovirus a alors été principalement identifiée (entre 65 et 81% de ces épisodes avec un agent identifié) et, pour 5 à 12% des épisodes, plusieurs étiologies ont été identifiées (tableau 3).
 Agrandir l'image
Agrandir l'image
Mesures de contrôle
Des mesures de contrôle ont été mises en place quasi-systématiquement lors des épisodes de GEA quelle que soit la saison de surveillance (98% pour les saisons 2010-2011 et 2011-2012, 99% pour les trois dernières saisons).
Le délai moyen de mise en place des mesures a diminué (p=0,02) de 1,7 jours (saison 2011-2012) à 1,3 jours (saison 2014-2015).
Les mesures de contrôle recommandées ont, de plus, été de mieux en mieux appliquées au fil des saisons (tableau 4).
 Agrandir l'image
Agrandir l'image
Étude des facteurs associés au taux d’attaque
Dans le modèle final (tableau 5), le taux d’attaque est significativement plus faible lorsque :
les mesures de contrôle ont été mises en place moins de 3 jours après le début des signes du premier cas : taux d’attaque diminué de 10% (IRR=0,90) si les mesures ont été mises en place avant le 3e jour après le début des signes du premier cas.
Le taux d’attaque est significativement plus élevé :
lorsqu’une recherche étiologique n’a pas été effectuée : taux d’attaque augmenté de 13% (Incidence Rate Ratio, IRR=1,13) comparé au taux d’attaque associé aux épisodes avec recherche étiologique ;
lorsque la durée de l’épisode augmente: taux d’attaque augmenté de 16% à 6 jours (IRR=1,16), de 33% à 9 jours (IRR=1,33) et de 48% à 13 jours (IRR=1,48), le tout comparé au taux d’attaque associé à une durée de l’épisode de 4 jours ;
lorsque les mesures liées à l’arrêt ou à la limitation d’activités des résidents ne sont pas mises en place : taux d’attaque augmenté de 17% (IRR=1,17) comparé au taux d’attaque si ces mesures ont été mises en place.
 Agrandir l'image
Agrandir l'image
Dans notre analyse, l’identification de plusieurs agents pathogènes dans un même épisode n’influençait pas le taux d’attaque (p=0,9). Il en est de même pour la mise à l’écart du personnel malade (p=0,1).
Le taux d’attaque pour les épisodes identifiés à norovirus seul est augmenté de 30% (p<0,001) par rapport au taux d’attaque pour les épisodes identifiés à rotavirus seul (résultats non présentés ici).
Discussion
Cette étude met en évidence le poids des épisodes de GEA dans les collectivités pour personnes âgées en termes de morbidité et létalité.
En collectivités, le norovirus a été identifié comme étant le principal virus responsable de GEA 3,4,5,6,7,8,9,10,16,17. Une proportion élevée d’épisodes à norovirus a également été identifiée dans les Ehpa de cette étude. Près des trois quarts des épisodes confirmés étaient dus à un norovirus, épisodes pour lesquels le taux d’attaque était également plus élevé. Ces éléments ont aussi été retrouvés lors de différentes études en France et dans d’autres pays 4,5,16,17,18,19,20,21,22.
Un nombre comparable d’épisodes déclarés au cours des saisons 2010-2011, 2011-2012 et 2013-2014 est observé. La saison 2012-2013 a été marquée par un nombre plus important d’épisodes, ce qui peut s’expliquer par la circulation d’un nouveau variant de norovirus GII.4 (Sydney) 23. En effet, les épidémies hivernales de GEA sont majoritairement provoquées par des norovirus de génogroupe II avec des évolutions régulières de génotype et de variants de génotype, ayant pour conséquence une immunité de la population qui peut varier. Le cycle actuellement observé de remplacement de ces variants est de deux ans 19. En France, sur les saisons 2010-2011 et 2011-2012, le norovirus responsable de la majorité des cas en Ehpa était le variant GII.4 New Orleans, qui a été remplacé courant 2012 par le variant GII.4 Sydney (données CNR). Aux États-Unis, en 2012-2013, le variant Sydney a affecté de façon disproportionnée les personnes âgées d’au moins 75 ans et, ce faisant, les établissements de soins de longue durée 24.
Il reste nécessaire de limiter la transmission du virus entre résidents et/ou personnels en appliquant les mesures d’hygiène recommandées 12,13,13. Ici, dans plus de 90% des épisodes, au moins une mesure de contrôle a été mise en place, avec une amélioration au fil des saisons. Les recommandations semblent avoir été bien comprises et mises en œuvre. On observe également une diminution du délai de mise en place des mesures depuis le début de la surveillance. La mise à l’écart du personnel malade restait néanmoins insuffisante. La difficulté de gestion et de remplacement du personnel soignant dans les structures de soins en est probablement la principale cause.
Une étude hollandaise sur l’impact des mesures de contrôle lors d’épidémies de norovirus a mis en évidence un taux d’attaque plus faible si ces mesures sont mises en place en moins de trois jours après le début des signes du premier cas. La mise à l’écart du personnel malade était identifiée comme la mesure la plus efficace 11. Dans notre étude, la mise en place de mesures en moins de trois jours était bien associée à un taux d’attaque significativement plus faible. Par ailleurs, pour 50% des épisodes, les mesures de contrôle ont été établies dès le premier cas de GEA identifié. Ici, seule la date l’établissement de la première mesure étant indiquée, l’interprétation des résultats sur l’impact des différentes mesures mises en place reste donc limitée.
Une étiologie a été recherchée dans près de la moitié des épisodes. Cependant, la proportion de recherches a diminué progressivement, passant de 57% pour 2010-2011 à 44% pour 2013-2014. Lors de la première saison de surveillance des GEA en Ehpad en Pays de la Loire (2010-2011), l’identification du virus responsable ne modifiait pas la gestion des épisodes 25. De plus, suivant les recommandations du Haut Conseil de la santé publique (HCSP), la mise en place immédiate de précautions doit être appliquée de façon stricte autour de chaque cas identifié sans attendre qu’un diagnostic étiologique soit posé. Néanmoins, dans notre étude, le taux d’attaque est plus élevé lorsqu’une recherche étiologique n’a pas été effectuée. Les établissements qui n’effectuent pas une telle recherche seraient peut-être moins sensibles à la gestion des épisodes de GEA, même si cette association reste difficile à interpréter. Une demande de recherche étiologique suite à un épisode de GEA en Ehpa reste au final recommandée et permet d’identifier et de caractériser des nouveaux virus circulants.
En régions, des travaux ont été conduits pour différencier les épisodes de toxi-infection alimentaire collective (Tiac) et les épisodes de GEA par transmission interhumaine à partir de l’analyse des courbes épidémiques transmises par les Ehpa 25. Ces courbes étant traitées uniquement au niveau régional, il n’a pas été possible de faire ce travail au niveau national.
La comparaison des taux d’incidence de diarrhées aiguës en population générale fournis par le réseau Sentinelles avec le nombre d’épisodes de GEA en Ehpa signalés montre que les tendances temporelles sont similaires.
Le système de surveillance des GEA en Ehpa présente néanmoins un certain nombre de biais. Ainsi, l’implication des autorités de santé est variable selon les régions. En effet, des régions particulièrement impliquées dans cette surveillance (études spécifiques, groupe de travail…) 5,20,25,26 ont un taux de signalement plus élevé (régions Ouest et Est de la France) pouvant être relié à une meilleure déclaration des épisodes.
Le taux d’attaque de GEA en Ehpa peut être surestimé, notamment pour les régions où le taux de signalement est le plus bas, avec une possible déclaration préférentielle des épisodes les plus importants. Il est également possible que des épisodes pour lesquels les mesures de contrôle n’ont pas été mises en place ne soient pas déclarés, pouvant ainsi contribuer à une sureprésentation des épisodes où les mesures de contrôle ont été mises en place.
Le délai de signalement a diminué au cours des saisons, passant de cinq jours en 2010-2011 à quatre jours en 2014-2015, pouvant suggérer une meilleure réactivité de la part des Ehpa, comme cela a également été observé pour les signalements des IRA en Ehpa au cours des saisons 2003 à 2011 27.
Les informations sur les causes d’hospitalisations et de décès n’étant pas demandées lors du signalement, les liens de causalité entre les épisodes de GEA et une hospitalisation et/ou un décès ne peuvent pas être analysés.
Enfin, des rétro-informations régulières (présentation d’indicateurs, animation du réseau), effectuées au niveau régional par les Cire, participent grandement à l’animation de ce système de surveillance des GEA et des IRA en Ehpa.
Conclusion
La surveillance spécifique des cas groupés de GEA en Ehpa a été initialement mise en place dans le but d’améliorer la prise en charge des épidémies de GEA dans les collectivités pour personnes âgées. Cette surveillance avait comme objectifs de détecter précocement les épisodes de GEA et de permettre une mise en place rapide des mesures de contrôles. Cette étude montre que les principaux objectifs de cette surveillance ont été atteints permettant de ce fait une meilleure gestion des épisodes de GEA en Ehpa. Les recherches étiologiques restent cependant peu nombreuses avec une diminution des envois de selles au CNR des virus entériques. Ces recherches sont pourtant importantes pour caractériser les virus circulants et comparer avec les autres pays européens 28,29.
Remerciements
Nous tenons à remercier Yann Le Strat, les membres du GEPP sur la surveillance des IRA et GEA en Ehpa, le réseau Sentinelle, les ARS, ARLIN, CCLIN et équipes opérationnelles d’hygiène hospitalière(EOH) ainsi que l’ensemble des Ehpa ayant participé au dispositif de surveillance.




