Migrants subsahariens suivis pour le VIH en France : combien ont été infectés après la migration ? Estimation dans l’Étude ANRS-Parcours
// Sub-Saharan African migrants followed-up for HIV infection in France: how many acquired HIV after migration? Estimations from the ANRS-PARCOURS Study
Résumé
Contexte –
Les données épidémiologiques disponibles suggèrent qu’une part non négligeable des migrants d’Afrique subsaharienne qui vivent avec le VIH en Europe ont été infectés après leur arrivée, sans que cette proportion soit précisément connue.
Matériel et méthodes –
Nous avons estimé la proportion de migrants subsahariens qui ont acquis le VIH après leur arrivée en France, en combinant les données biographiques et cliniques recueillies au sein d’un échantillon représentatif de patients nés en Afrique subsaharienne et suivis pour une infection à VIH dans les hôpitaux d’Île-de-France.
L’infection était considérée comme acquise en France si l’un des critères biographiques suivants était rempli : 1) une durée de séjour en France avant le diagnostic d’au moins 11 ans, 2) un test VIH négatif après l’arrivée en France, 3) le premier rapport sexuel après l’arrivée en France. Lorsqu’aucun de ces critères n’était rempli, nous avons estimé la durée depuis la contamination à partir de la première mesure des CD4 en utilisant un modèle statistique de déclin des CD4. Cette durée a été estimée 500 fois pour chaque enquêté. Nous avons considéré que la contamination était survenue en France si au moins 50% (en scénario médian) ou au moins 95% (en scénario conservateur) des 500 durées estimées étaient inférieures à la durée de vie en France.
Résultats –
Parmi 898 adultes infectés par le VIH nés dans un pays d’Afrique subsaharienne, nous avons estimé que 49% [IC95%:45-53] d’entre eux en scénario médian et 35% [31-39] en scénario conservateur ont acquis le VIH après leur arrivée en France. Cette proportion était plus basse pour les femmes que pour les hommes (30% [25-35] vs. 44% [37-51] dans le scénario conservateur) et augmentait avec la durée du séjour en France.
Conclusion –
Au vu de cette proportion importante de migrants d’Afrique subsaharienne infectés par le VIH après la migration, il apparaît nécessaire d’améliorer la prévention dans ce groupe de population et, pour cela, de mieux comprendre les déterminants de ces infections survenues en France.
Abstract
Context –
Although recent epidemiological data suggest that a substantial proportion of migrants from Sub-Saharan Africa living in Europe acquired HIV after their arrival, few estimates are available to date.
Material and methods –
We estimated the proportion of Sub-Saharan migrants who acquired HIV infection after their arrival in France using life-event and clinical information on a representative random sample of HIV-infected hospital outpatients born in Sub-Saharan Africa living in the Paris region.
We assumed that HIV infection had probably been acquired in France if at least one of the following life-event criterion was met: 1) HIV diagnosis ≥11 years after arrival in France, 2) negative HIV test in France, 3) first sexual intercourse after arrival in France. If none of these criteria were met, we estimated the duration from HIV infection based on first CD4 count measurement using statistical modelling for CD4 decrease. Infection occurred in France if, out of 500 durations estimated for each individual, at least >50% (median scenario) or >95% (conservative scenario) fell within the period while individuals were living in France.
Results –
Out of 898 HIV-infected adults born in Sub-Saharan Africa, we estimated that 49% of them [95%CI:45-53] according to a median scenario and 35% of them [31-39] according to a conservative scenario acquired HIV after their arrival in France. This proportion was lower in women than in men (30% [25-35] vs. 44% [37-51] according to the conservative scenario) and increased with the length of stay in France.
Conclusion –
Our findings reveal a high proportion of HIV infections among Sub-Saharan Africa migrants after their arrival in France. They highlight the need for improved prevention policies for HIV in this population, and for a better understanding of the determinants of these infections in France.
Introduction
En France, comme dans la plupart des pays d’Europe de l’Ouest, les personnes originaires d’Afrique subsaharienne sont particulièrement touchées par l’épidémie de VIH/sida 1. Parmi les personnes suivies pour le VIH en France, 24% sont nées dans un pays d’Afrique subsaharienne 2 alors que cette population ne représente que 1% de la population française 3. Malgré une baisse du nombre de nouveaux diagnostics chez les migrants subsahariens dans la dernière décennie, ces derniers représentaient encore 31% des nouveaux diagnostics VIH en 2012 4.
Les migrants subsahariens venant de pays où la prévalence du VIH est élevée 5, l’hypothèse d’une contamination antérieure à leur arrivée en France a longtemps été privilégiée. Cependant, plusieurs travaux en Europe suggèrent qu’une partie des migrants d’Afrique subsaharienne pourrait avoir acquis l’infection à VIH après la migration 1. Au Royaume-Uni, cette proportion a été récemment estimée à 31% en s’appuyant sur une modélisation du déclin des CD4 6, mais on ne dispose pas d’estimation similaire pour les autres pays d’Europe.
Dans cette étude, nous avons estimé la proportion des migrants d’Afrique subsaharienne qui ont été infectés en France parmi ceux suivis pour une infection VIH, en combinant des données biographiques et cliniques recueillies dans l’enquête Parcours. Cette enquête a été menée auprès de personnes nées en Afrique subsaharienne et vivant en Île-de-France, région la plus touchée par le VIH 4 et où vit la majeure partie des migrants subsahariens en France 3.
Matériel et méthodes
L’enquête ANRS-Parcours
L’enquête ANRS-Parcours 7 est une enquête transversale biographique conduite en 2012-2013 auprès de trois échantillons aléatoires de personnes originaires d’Afrique subsaharienne en Île-de-France : l’un constitué de personnes infectées par le VIH, un autre constitué de personnes porteuses d’une hépatite B chronique, et un groupe de personnes n’ayant aucune de ces deux infections. Cet article porte exclusivement sur le groupe de personnes infectées par le VIH.
L’enquête a été effectuée entre le 30 janvier et le 31 décembre 2012 au sein de 24 services hospitaliers tirés au sort parmi les 37 services suivant des patients VIH en Île-de-France et ayant une file active d’au moins 100 patients originaires d’Afrique subsaharienne, stratifiés proportionnellement à leur nombre de migrants subsahariens. Dans chaque service participant, tous les patients nés dans un pays d’Afrique subsaharienne et de nationalité d’un pays d’Afrique subsaharienne à la naissance, âgés de 18 à 59 ans et diagnostiqués VIH depuis au moins trois mois, étaient éligibles. Tous les consultants éligibles étaient sollicités par leur médecin pour participer à l’enquête, sauf si celui-ci le jugeait inopportun en raison d’un problème de santé ou de difficultés d’ordre linguistique (malgré le fait que le questionnaire était disponible en français et en anglais, et que le recours sur rendez-vous à un service d’interprétariat était proposé). En cas d’accord pour participer, un consentement écrit était recueilli par le médecin.
Informations recueillies
Pour tous les participants, des informations détaillées sur l’histoire migratoire, les conditions socioéconomiques, l’activité sexuelle et les évènements de santé au cours de la vie (en particulier les hospitalisations) ont été collectées au moyen d’un « questionnaire patient » biographique standardisé administré en face-à-face par un enquêteur spécialement formé. Pour chaque dimension d’intérêt, les informations étaient documentées pour chaque année, de la naissance à l’année de l’enquête. Les informations cliniques étaient recueillies à partir des dossiers médicaux par le personnel soignant.
Cette étude utilise trois informations collectées dans le questionnaire patient : l’année d’arrivée en France, l’année du premier rapport sexuel et l’existence éventuelle de tests de dépistage du VIH négatifs après l’arrivée en France.
L’année du diagnostic était déclarée par le participant et recueillie dans le dossier médical. Les deux informations étaient concordantes (i.e., même année +/-1) dans 81% des cas. Lorsqu’il y avait discordance, nous avons retenu la date la plus ancienne.
Le nombre de CD4 au moment 1) du diagnostic VIH, 2) du début du traitement antirétroviral (ARV) le cas échéant et 3) de l’enquête, a été renseigné à partir du dossier médical. Nous avons défini comme première mesure des CD4 leur nombre au diagnostic ou, lorsque cette information était manquante, la première mesure des CD4 avant initiation du traitement ARV.
Éthique
Toutes les données étaient collectées de façon anonyme. Chaque participant a reçu une indemnisation de 15€ sous forme de bon d’achat. L’enquête a reçu un avis favorable du Comité consultatif sur le traitement de l’information en matière de recherche dans le domaine de la santé (CCTIRS) et l’autorisation de la Commission nationale de l’informatique et des libertés (Cnil).
Analyses statistiques
Pour déterminer si l’infection VIH avait eu lieu avant ou après l’arrivée en France, nous avons combiné les données biographiques et les données de CD4.
En nous appuyant sur les données biographiques, nous avons tout d’abord classé comme infectées avant l’arrivée en France les personnes pour lesquelles l’année du diagnostic VIH était antérieure à l’arrivée en France. Ensuite, nous avons considéré que la personne avait été infectée après l’arrivée en France si au moins un des trois critères suivants était rempli : 1) avoir été diagnostiqué VIH+ au moins 11 ans après l’arrivée en France 8, 2) avoir eu au moins un test de dépistage du VIH négatif depuis l’arrivée en France, 3) avoir eu son premier rapport sexuel après l’arrivée en France, sans élément rendant plausible une infection périnatale ou par voie transfusionnelle (pas de diagnostic dans l’enfance, pas d’hospitalisation en Afrique).
Lorsqu’aucun de ces critères n’était rempli, nous avons utilisé les données sur la première mesure des CD4 dans le suivi clinique et une modélisation du déclin des CD4 pour estimer le nombre d’années écoulées entre l’infection par le VIH et la première mesure des CD4. La modélisation du déclin des CD4 a été réalisée à partir d’une cohorte de séroconverteurs africains, la cohorte ANRS 1220 Primo-CI suivie à Abidjan, Côte d’Ivoire. Cette cohorte comprend 352 donneurs de sang (61% d‘hommes ; âge médian à l’infection : 28,8 ans) suivis de 1997 à 2011, avec au moins un test de dépistage du VIH négatif et un test positif à dates connues et au moins deux mesures de CD4 avant l’initiation du traitement ARV 9. Le déclin des CD4 après l’infection dans cette cohorte a été modélisé en utilisant un modèle linéaire mixte à effets aléatoires décrit ailleurs, à partir duquel nous avons construit une équation permettant d’estimer la durée entre la séroconversion au VIH et la première mesure des CD4 10.
Cette équation a ensuite été utilisée pour estimer le temps écoulé entre la séroconversion VIH et la première mesure de CD4 chez les participants de l’enquête Parcours concernés 11. Pour chaque participant, cette durée a été estimée 500 fois. Deux scénarios ont ensuite été considérés pour déterminer si l’infection avait eu lieu après l’arrivée en France : dans le scénario médian, l’infection était considérée comme survenue en France pour un enquêté si au moins 50% des 500 durées estimées pour celui-ci étaient inférieures à la durée de sa vie en France ; dans le scénario conservateur, il fallait que 95% des durées estimées soient inférieures à la durée de vie en France pour considérer que l’infection avait eu lieu en France.
Les associations entre l’infection VIH après l’arrivée en France selon la date estimée dans le scénario conservateur et les caractéristiques sociodémographiques, l’âge à l’arrivée en France et la durée du séjour en France avant le diagnostic VIH, ont été mesurées par des tests du Chi2 de Pearson. Les données ont été pondérées pour tenir compte du plan de sondage et de la non-participation. Les analyses ont été conduites avec Stata® 13.0.
Résultats
Sur 1 829 patients éligibles, 141 n’ont pas été sollicités par le médecin et 926 ont accepté de participer, soit un taux de participation de 55%. Ce taux variait avec la situation vis-à-vis de l’emploi : il était plus élevé chez les hommes sans emploi que chez ceux qui travaillaient (60,1% contre 49,0%, p=0,05), mais pas chez les femmes. Il ne différait pas selon le sexe, l’âge, ni le niveau de CD4. Vingt-huit personnes ont été exclues de l’analyse pour données manquantes. Parmi les 898 personnes sur lesquelles porte l’analyse, 550 étaient des femmes et 348 des hommes. L’âge médian à l’arrivée en France était de 28 ans pour les femmes [intervalle interquartile : 23-34] et 30 ans pour les hommes [25-37]. Les principaux pays d’origine étaient la Côte d’Ivoire (24%), le Cameroun (20%), la République Démocratique du Congo (13%), le Mali (9%) et le Congo-Brazzaville (7%). La plupart (81%) avaient été scolarisés au moins jusqu’au secondaire. Au moment de l’enquête, les participants étaient âgés de 43 ans en médiane (40 pour les femmes et 47 pour les hommes) et ils vivaient en France depuis 12 ans en médiane [7-20]. Au moment du diagnostic, la durée médiane du séjour en France était de 3 ans [1-9] et le nombre médian de CD4 était de 274/mm3 [129-430].
Cent trente-trois (133) personnes avaient été diagnostiquées infectées par le VIH avant l’arrivée en France. Sur la base des éléments biographiques, 228 pouvaient être classées comme infectées après l’arrivée en France : 137 avaient été diagnostiquées 11 ans ou plus après l’arrivée, 63 avaient eu un test de dépistage négatif en France, 28 avaient commencé leur vie sexuelle en France et n’avaient été infectées ni par voie materno-foetale ni par transfusion. Parmi les 537 personnes restantes, l’estimation de la durée entre l’infection VIH et la première mesure de CD4 a permis d’en classer 197 comme infectées en France en utilisant le scénario médian et 69 en utilisant le scénario conservateur (figure). Cela conduit à une estimation globale de 49% (IC95%:[45-53]) de migrants infectés par le VIH après leur arrivée en France en scénario médian, et de 35% [31-39] en scénario conservateur.
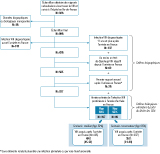 Agrandir l’image
Agrandir l’image
Cette proportion était plus basse pour les femmes que pour les hommes (30% [25-35] vs. 44% [37-51] en scénario conservateur), et plus élevée parmi les migrants arrivés en France jeunes ou depuis longtemps (tableau). Il n’y avait pas de différence selon le niveau d’études, la région du pays de naissance ou la période de diagnostic.
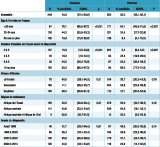 Agrandir l’image
Agrandir l’image
Discussion
Cette étude est la première en France à estimer la proportion de migrants subsahariens infectés après leur arrivée en France parmi ceux qui sont suivis pour le VIH.
Notre estimation est basée sur un échantillon représentatif de patients suivis pour le VIH dans les hôpitaux d’Île-de-France. Étant donné que la majorité des patients infectés par le VIH nés dans un pays d’Afrique subsaharienne et résidant en France vivent dans cette région (69% des femmes et 74% des hommes) 12 et que le suivi du VIH en France se fait essentiellement dans les hôpitaux, nos résultats concernent la grande majorité des migrants subsahariens suivis pour le VIH en France. La solidité de notre estimation vient de la combinaison des données biographiques et biologiques. Bien que déclaratives, les données biographiques recueillies sur l’histoire de la migration, des dépistages et de l’entrée dans la sexualité sont de qualité car la collecte biographique facilite la remémoration des évènements et de leur enchaînement dans le temps 13. De plus, nous avons vérifié la cohérence entre les dates et circonstances des tests de dépistage négatifs et les autres évènements de vie, en particulier les grossesses et les situations sexuelles. Nous avons estimé que les personnes diagnostiquées au moins 11 ans après leur arrivée en France avaient été infectées en France car selon Ndawinz et coll. 8, compte tenu de l’histoire naturelle de l’infection, la probabilité chez les personnes non françaises de rester non diagnostiquées 11 ans après leur contamination est très faible : respectivement 0,004 pour les femmes et 0,026 pour les hommes.
La modélisation du déclin des CD4 a été faite à partir d’une population d’Afrique de l’Ouest (Abidjan, Côte d’Ivoire) pour tenir compte des spécificités génétiquesde l’histoire naturelle des CD4 au cours de l’infection VIH. Dans notre population d’étude, la grande majorité des migrants (96%) venait d’Afrique de l’Ouest ou d’Afrique Centrale, les deux principales régions dont sont issus les flux migratoires de l’Afrique vers la France. Étant donné que la progression de l’infection VIH ne diffère pas entre les personnes originaires d’Afrique de l’Ouest et d’Afrique Centrale 14, la modélisation des CD4 à partir d’une population d’Afrique de l’Ouest peut s’appliquer à l’ensemble de notre échantillon.
Le fait que la probabilité d’avoir été infecté(e) en France est d’autant plus élevée que la durée de séjour en France est longue et que l’âge à l’arrivée est faible confirme la validité de notre estimation.
Cependant, malgré les chiffres élevés que nous obtenons, il est probable que nous ayons sous-estimé légèrement le phénomène d’infections VIH en France. Tout d’abord, nous n’avons pas tenu compte des facteurs environnementaux qui peuvent aussi influer l’histoire naturelle des CD4. Or, chez les Africains diagnostiqués en Europe, le délai entre l’infection VIH et un certain niveau de CD4 est plus court que chez ceux diagnostiqués en Afrique 15. Notre modélisation peut donc nous conduire à une sous-estimation du nombre d’infections en France. D’autre part, en cas de discordance entre la déclaration du patient et l’information issue du dossier médical, nous avons retenu la date de découverte de séropositivité la plus ancienne, ce qui peut conduire aussi à sous-estimer la proportion d’infectés en France.
D’après nos résultats, un tiers (en scénario conservateur) à la moitié (en scénario médian) des migrants d’Afrique subsaharienne suivis pour le VIH en France ont été infectés après être arrivés en France. Les données de surveillance du VIH avaient déjà montré que 28% des migrants subsahariens nouvellement diagnostiqués pour un VIH sur la période 2003-2010 étaient infectés par un sous-type B, qui est très rare en Afrique, ce qui suggérait une acquisition du VIH en Europe 16. Dans notre étude, lorsque nous considérons uniquement les individus diagnostiqués depuis 2003 (N=508), nous obtenons une estimation de 35% d’infectés en France en scénario conservateur (IC95%:[29-40]), donc plus élevée. Cela est cohérent avec le fait que certains migrants aient pu s’infecter en France avec un sous-type non B, en particulier au sein des réseaux sexuels intra-africains.
Au Royaume-Uni, en utilisant un scénario médian, cette proportion a été estimée à 31% 6. Nos résultats suggèrent donc que la proportion des migrants africains suivis pour le VIH et qui ont acquis leur VIH dans le pays hôte est plus importante en France (49% en scénario médian) qu’au Royaume-Uni.
Les hommes ont plus fréquemment acquis le VIH en France que les femmes. Ce résultat est cohérent avec l’épidémiologie du VIH en Afrique, qui touche davantage les femmes que les hommes et à un âge plus précoce. Étant donné que les femmes et les hommes sont arrivés sensiblement au même âge en France (30 et 28 ans en médiane, respectivement, dans notre échantillon), les femmes ont une plus grande probabilité d’avoir été déjà infectées par le VIH lorsqu’elles arrivent en Europe. Cela suggère aussi que les hommes prennent sans doute plus de risques sexuels que les femmes après la migration, comme certains travaux en France et au Royaume-Uni l’ont déjà souligné 17,18.
Ces niveaux élevés d’acquisition du VIH en France remettent en question le postulat d’une épidémie VIH chez les migrants africains vivant en Europe qui serait essentiellement importée d’Afrique. En conséquence, ils nous indiquent que la lutte contre le VIH dans cette population ne passe pas seulement par un bon accès au dépistage dans la première période de l’immigration, permettant une prise en charge rapide de ceux qui arrivent infectés. Il apparaît aussi nécessaire de mieux connaître les comportements et les risques sexuels des migrants d’Afrique subsaharienne après l’arrivée en France et leurs déterminants, pour mieux prendre en compte les besoins de cette population en termes de prévention, et renforcer les politiques de santé spécifiques et adaptées déjà en place.
*Le groupe ANRS-Parcours
Le groupe Parcours est composé de : A. Desgrées du Loû, F. Lert, R. Dray-Spira, N. Bajos, N. Lydié (responsables scientifiques), J. Pannetier, A. Ravalihasy, A. Gosselin, E. Rodary, D. Pourette, J. Situ, P. Revault, P. Sogni, J. Gelly, Y. Le Strat, N. Razafindratsima.
Les investigateurs
Centre hospitalier intercommunal de Créteil (I. Delacroix, B. El Harrar, V. Garrait, L. Richier) ; CHU du Kremlin-Bicêtre (M. Duracinski, Y. Quertainmont, C. Goujard, D. Peretti, K. Bourdic) ; Centre hospitalier de Saint-Denis, Hôpital Delafontaine (G. Tran Van, M.A. Khuong, M. Poupard, J. Krause, B. Taverne) ; Centre hospitalier de Gonesse (D. Trois Vallets, V. Favret) ; Centre hospitalier de Pontoise, Hôpital René Dubos (L. Blum, M. Deschaud) ; CHI Poissy/Saint-Germain-en-Laye (Y. Welker, H. Masson, B. Montoya, J.L. Ecobichon) ; CH de Lagny Marne-la-Vallée (E. Froguel, P. Simon, M.S. Nguessan, S. Tassi) ; Nouveau Centre hospitalier Sud Francilien (A. Devidas, L. Gérard, H. Touahri) ; CHI Robert Ballanger (J.L. Delassus, M.A. Bouldouyre, V. Favret) ; Hôpital Intercommunal André Grégoire (C. Winter) ; Centre médical Institut Pasteur (C. Charlier-Woerther, O. Lortholary, P.H. Consigny, A. Gergely, M. Shoai-Tehrani, G. Cessot, C. Duvivier, F. Touam, K. Benhadj) ; CMC de Bligny (H. Ait Mohand, E. Klement, P. Chardon). Assistance publique-Hôpitaux de Paris (AP-HP) : Hôpital Tenon (P. Bonnard, M.G. Lebrette, H. Cordel, F.X. Lescure, J.P. Vincensini, A. Adda Lievin, P. Thibault, N. Velazquez) ; Hôpital Lariboisière (J.F. Bergmann, E. Badsi, J. Cervoni, M. Diemer, A. Durel, P. Sellier, M. Bendenoun, J.D. Magnier) ; Hôpital Saint-Antoine (E. Bui, J. Tredup, P. Campa, N. Desplanque, M. Sebire) ; Hôpital Saint-Louis (D. Ponscarme, N. Colin de Verdière, V. de Lastours, J. Gouguel, C. Gatey, C. Lascoux-Combe, V. Garrait, F. Taieb, N. De Castro, L. Gérard) ; Hôpital Bichat-Claude Bernard (G. Pahlavan, B. Phung, F. L’Hériteau, A. Dia, A. Leprêtre, G. Morau, C. Rioux, V. Joly, Y. Yazdanpanah, S. Legac) ; Hôpital Européen Georges Pompidou (M. Buisson, P. Kousignian, C. Minozzi, M. Karmochkine, D. Batisse, J. Pavie, M. Eliaczewicz, L. Weiss, G. Gonzalez, P. Castiel, I. Pierre, M. Beumont, D. Jayle, J. Derouinau, M. Manea, E. Bourzam) ; Hôpital Avicenne (S. Abgrall, S. Mattioni, R. Barruet, N. Sayre, O. Bouchaud, M. Tatay, M. Gousseff, F. Mechai, T. Kandel, P. Honoré, M. Coupard) ; Hôpital Cochin-Tarnier (F. Bani-Sadr, L. Belarbi, G. Spiridon, T. Tahi, H. Mehawej, D. Salmon, B. Silbermann, A. Calboreanu, P. Loulergue, H. Bouchez, V. Le Baut, M.P. Pietri) ; Hôtel-Dieu (J.P. Viard, A. Sobel, J. Gilquin, A. Cros, A. Maignan) ; Hôpital La Pitié-Salpêtrière (S. Pelletier, M.C. Samba, S. Herson, A. Simon, M. Bonmarchand, N. Amirat, N. Smail, S. Seang, H. Stitou, L. Schneider, R. Tubiana, L. Epelboin, M.A. Valantin, C. Katlama, S. Ben Abdallah, P. Bourse, Y. Dudoit, C. Blanc).
Remerciements
L’étude Parcours a été financée par l’Agence nationale de recherche contre le sida et les hépatites virales (ANRS), avec le soutien de la Direction générale de la Santé.
Les auteurs remercient :
- toutes les personnes qui ont accepté de participer à l’enquête ANRS-Parcours ;
- les associations qui ont apporté leur soutien à l’étude, notamment SOS Hépatites (M. Cizorne), le Comede (P. Revault, A. Veïsse, L. Wolmark), le RAAC-sida (Réseau des associations africaines et caribéennes de lutte contre le sida) et le FORIM (JC. Ahomadegbe, K. Sakho) ;
- le groupe Primo-CI (A. Minga et X. Anglaret) dont les investigateurs ont accepté de partager leurs données sur le déclin naturel des CD4 dans la cohorte de séroconverteurs Primo-CI à Abidjan ;
- G. Vivier, E. Lelièvre (Institut national d’études démographiques) et A. Gervais (AP-HP) pour leur contribution à la préparation des questionnaires ; A. Guillaume (Institut de recherche pour le développement) pour la communication sur l’enquête.
Le recueil des données a été assuré par les sociétés ClinSearch et Ipsos.




