Évolution des résistances du gonocoque aux antibiotiques en France de 2001 à 2012
// Trends of antibiotic resistance of Neisseria gonorrhoeae in France, from 2001 to 2012
Résumé
Contexte –
Depuis la fin des années 1990, une recrudescence mondiale des gonococcies et une augmentation des résistances aux antibiotiques ont été constatées. Les multirésistances pourraient aboutir à une impasse thérapeutique. Cet article décrit l’évolution des résistances du gonocoque aux antibiotiques en France sur une période de 12 années (2001-2012) ainsi que les facteurs associés à la baisse de sensibilité aux céphalosporines.
Méthode –
La surveillance des infections à gonocoque est réalisée grâce au réseau Rénago de laboratoires volontaires qui collectent des données épidémiologiques. Les souches sont adressées au Centre national de référence qui détermine la concentration minimale inhibitrice (CMI) pour six antibiotiques.
Résultats –
Entre 2001 et 2012, le nombre de gonococcies a régulièrement augmenté. La sensibilité de 8 649 souches a été étudiée pendant cette période. La proportion de souches résistantes a fluctué autour de 13% pour la pénicilline, a augmenté jusqu’à 56% en 2012 pour la tétracycline et a augmenté et est restée élevée autour de 42% pour la ciprofloxacine. La proportion de souches résistantes pour le céfixime (CMI >0,125 mg/L) a quadruplé entre 2011 (0,7%) et 2012 (3,0% ; p<0,001). Seules 2 souches sur 8 649 avaient une CMI de la ceftriaxone >0,125 mg/L, toutes deux en 2010. La baisse de sensibilité pour les céphalosporines augmente avec l’âge des patients et est plus fréquente pour les souches pharyngées.
Conclusion –
L’augmentation des résistances au céfixime pourrait témoigner d’une application insuffisante de la recommandation nationale d’utiliser la ceftriaxone en première intention dans le traitement probabiliste des urétrites et cervicites. Une surveillance renforcée des souches pharyngées est proposée.
Abstract
Background –
Since the late 1990s, a global resurgence of gonorrhoea and an increased resistance to antibiotics has been observed. Multidrug resistance may lead to untreatable gonococcal infections. This article describes the trends of antibiotic resistance of Neisseria gonorrhoeae in France over a 12 year period (2001-2012), as well as the factors associated with decreased susceptibility to cephalosporins.
Method –
The monitoring of gonococcal infections is achieved through a network of voluntary laboratories that collects epidemiological data (Rénago). The strains were sent to the National Reference Laboratory for determining the minimum inhibitory concentration (MIC) for six antibiotics.
Results –
Between 2001 and 2012, the number of gonorrhoea infections increased steadily. The susceptibility of 8,649 strains was studied during this period. The proportion of resistant strains fluctuated around 13% for penicillin. It increased up to 56% in 2012 for tetracycline. It increased and remained high at around 42% for ciprofloxacin. The proportion of resistant strains for cefixime (MIC>0.125 mg/L) increased fourfold between 2011 (0.7%) and 2012 (3.0%, p<0.001). Only two of the 8,649 strains had a MIC of ceftriaxone >0.125 mg/L, both in 2010. The decreased susceptibility to cephalosporins increased with patients’ age and was more common for pharyngeal strains.
Conclusion –
The increased resistance to cefixime could indicate a lack of implementation of the national recommendation to use ceftriaxone as first line in the probabilistic treatment of urethritis and cervicitis. Enhanced surveillance of pharyngeal strains is proposed.
Introduction
La gonococcie est une infection sexuellement transmissible (IST) habituellement responsable d’infections génitales non compliquées. Cependant, elle peut parfois occasionner des complications sévères (salpingites, orchi-épididymites, septicémies) 1,2 et elle accroît le risque de contamination par le VIH 2. L’incidence de la gonococcie, du fait de sa très courte incubation (généralement 2 à 5 jours) et d’une symptomatologie bruyante chez l’homme, représente un indicateur très sensible du relâchement des comportements et un signal d’alerte précoce par rapport au risque accru d’infection par le VIH 2.
À la suite des campagnes de prévention du sida dans les années 1980 et au début des années 1990, le nombre de nouveaux cas de gonococcie avait chuté dans plusieurs pays d’Europe de l’Ouest 3, y compris en France 4. Cette baisse s’expliquait par une diminution des comportements sexuels à risque 5. L’arrivée des multithérapies antirétrovirales au milieu des années 1990 s’est accompagnée d’une résurgence des comportements sexuels à risque dans la population générale, et plus particulièrement chez les hommes ayant des rapports sexuels avec les hommes (HSH), et d’une recrudescence des cas de gonococcie en Europe de l’Ouest 4,5 et aux États-Unis 6.
En France, la surveillance épidémiologique des gonococcies repose sur deux réseaux sentinelles volontaires constitués, pour l’un, de cliniciens (réseau RésIST) et pour l’autre, de laboratoires (réseau Rénago : réseau national des gonocoques) 7,8. À travers ces deux réseaux, on observe une augmentation des gonococcies depuis le début de la décennie 2000, chez l’homme comme chez la femme 8. Le réseau RésIST permet en outre de constater que cette augmentation existe quelle que soit l’orientation sexuelle 7,8.
Parallèlement à cette recrudescence, de nombreux pays ont rapporté, à la fin des années 1990 et au début des années 2000, des taux croissants de résistance du gonocoque à la ciprofloxacine 2,9, une fluoroquinolone qui était alors le traitement oral « minute » de première intention de la gonococcie urogénitale non compliquée. Les céphalosporines de troisième génération (C3G) en dose unique, céfixime oral et ceftriaxone injectable, ont dès lors représenté les traitements de première intention 10, ce qui a été la recommandation en France fin 2005 11. L’apparition de résistances cliniques et biologiques aux C3G, principalement au céfixime, mais aussi plus récemment à la ceftriaxone, pourrait aboutir à moyen terme à une impasse thérapeutique 2,10. La surveillance de la sensibilité du gonocoque est donc primordiale.
Dans ce contexte préoccupant, l’objectif de cette étude était de décrire l’évolution en France, entre 2001 et 2012, de la sensibilité des souches de gonocoques aux antibiotiques ainsi que les facteurs associés à la résistance aux C3G.
Méthodes
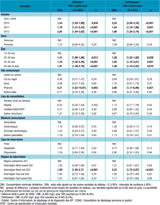
Les laboratoires du réseau Rénago, privés dans plus de deux tiers des cas et hospitaliers dans moins d’un tiers des cas, sont répartis sur l’ensemble de la France métropolitaine. Ce réseau permet de surveiller la résistance des souches de Neisseria gonorrhoeae aux antibiotiques. Les laboratoires participent volontairement et envoient leurs souches isolées par culture à l’Institut Alfred Fournier à Paris, Centre national de référence des gonocoques (CNR). Un cas de gonococcie est défini par une culture positive ou un test de biologie moléculaire (test d’amplification des acides nucléiques, TAAN) positif. Une fiche épidémiologique anonyme, complétée par le biologiste, collecte pour chaque patient les informations suivantes : sexe, âge, date de prélèvement, site anatomique de prélèvement, caractère symptomatique ou non de l’infection, existence d’IST associées, pays probable de contamination, notion de partenaire infecté, lieu de consultation et type de médecin prescripteur, type de laboratoire et département (tableau 1). Ces informations sont centralisées et analysées par l’Institut de veille sanitaire (InVS).
 Agrandir l'image
Agrandir l'image
En raison du nombre trop important de souches reçues par le CNR et de limitations budgétaires, l’InVS et le CNR ont décidé de réduire de moitié le nombre de laboratoires envoyant leurs souches au CNR à partir de janvier 2012, en conservant une répartition géographique homogène des laboratoires poursuivant cette surveillance microbiologique. D’autres critères ont été retenus, comme l’utilisation effective par les laboratoires des résultats de l’antibiogramme effectué par le CNR et les desiderata des laboratoires lors d’une enquête effectuée auprès de l’ensemble du réseau Rénago (données non publiées). La collecte des données épidémiologiques a continué pour l’ensemble des laboratoires du réseau.
Le CNR détermine la concentration minimale inhibitrice (CMI) pour six antibiotiques (pénicilline, tétracycline, ciprofloxacine, spectinomycine, ceftriaxone et, depuis 2008, céfixime) au moyen de bandelettes E-test, un changement d’E-test ayant eu lieu en mai 2011. Ces antibiotiques ont été par le passé ou sont actuellement recommandés pour le traitement des gonococcies 10. La présence de β-lactamase est détectée à l’aide des galeries d’identification Api NH et, en cas de doute, par un test de céphalosporine chromogène. Les critères de définition des résistances utilisés (tableau 2) sont ceux de l’European Committee on Antimicrobial Susceptibility Testing (EUCAST), mis à jour en 2013 12. Pour les C3G, il n’existe pas de seuil défini pour la résistance ; par simplification de langage, les souches ayant une CMI >0,125 mg/L pour le céfixime ou la ceftriaxone sont qualifiées de « résistantes » dans cet article. Une souche a été considérée multirésistante si elle était résistante à la pénicilline, la tétracycline, la ciprofloxacine et au céfixime.
Les analyses statistiques ont été réalisées avec le logiciel Stata® version 11.0. Les proportions ont été comparées avec le test de Fisher et les moyennes avec le test de Kruskal-Wallis, avec un seuil de significativité de 5%. Les facteurs associés à la baisse de sensibilité des C3G chez les patients d’au moins 15 ans ont été déterminés par des analyses uni- et multivariée en excluant les cas avec des valeurs manquantes. Le nombre de souches résistantes aux C3G étant trop limité pour de telles analyses, nous avons étudié les facteurs associés à un abaissement de sensibilité : CMI≥0,094 mg/L pour le céfixime et CMI≥0,032 mg/L pour la ceftriaxone, permettant pour chacun des deux antibiotiques d’avoir au moins 6% de souches. En raison de la proportion élevée de données manquantes pour 4 variables (existence de symptômes, existence d’IST associées, lieu de contamination, notion de partenaire infecté), celles-ci ont exclusivement fait l’objet d’une analyse univariée. Pour les autres variables, seuls les résultats de l’analyse multivariée sont présentés ici, les odds ratio bruts étant proches des odds ratio ajustés.
 Agrandir l'image
Agrandir l'image
Résultats
Évolution du nombre de gonococcies et de souches analysées
Entre 2001 et 2012, 13 386 cas de gonococcie ont été déclarés par les laboratoires du réseau, 11 920 ayant été diagnostiqués par culture. Parmi ces cas, 10 501 souches de gonocoques (88%) ont été envoyées au CNR, dont 8 649 (82% des souches envoyées) ont pu être remises en culture pour déterminer la sensibilité du gonocoque aux antibiotiques. Ce taux de remise en culture des souches envoyées au CNR a été assez stable depuis 2005 (minimum : 82% en 2011, maximum : 87% en 2012).
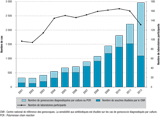
La figure 1 montre l’accroissement du nombre de cas déclarés et du nombre de souches étudiées par le CNR entre 2001 et 2012. Pendant cette période, le nombre de laboratoires participant à la surveillance épidémiologique a fortement augmenté entre 2001 (n=97) et 2005 (n=151), est resté assez stable puis a diminué entre 2011 (n=161) et 2012 (n=132). Le nombre de souches dont la sensibilité aux antibiotiques a été étudiée par le CNR a décuplé entre 2001 et 2011, passant de 150 à 1 521. En 2012, avec un nombre de laboratoires participant à la surveillance microbiologique réduit de moitié, 1 093 souches ont été testées.
On assiste ces dernières années à une montée en charge des diagnostics par TAAN. En effet, la détection par TAAN était intégrée au diagnostic biologique de la gonococcie dans seulement 3,9% des cas jusqu’en 2009, puis dans 13,1% en 2010, 25,1% en 2011 et 47,0% en 2012. La détection par TAAN était la méthode exclusive du diagnostic de gonococcie au sein du réseau Rénago pour respectivement 1,6%, 7,5%, 13,7% et 28,4% des patients de 2009 à 2012.
 Agrandir l'image
Agrandir l'image
Caractéristiques des patients
Les principales caractéristiques sociodémographiques des cas de gonococcie déclarés sont indiquées dans le tableau 1. Il s’agissait très majoritairement d’hommes (81% sur l’ensemble de la période d’étude), mais la proportion de femmes a été en constante augmentation pour atteindre 31% des cas en 2012. La tranche d’âge 15-34 ans était la plus touchée, et en constante augmentation pour les deux sexes. L’âge médian était plus élevé chez les hommes (29 ans contre 22 ans chez les femmes sur l’ensemble de la période d’étude) et a diminué récemment chez les hommes (de 30 ans entre 2001 et 2009 à 26 ans en 2012), comme chez les femmes (de 24 ans entre 2001 et 2009 à 21 ans en 2012).
L’information sur l’existence de symptômes manquait dans 33% des cas ; lorsqu’elle était disponible, 98% des hommes et 73% des femmes présentaient des symptômes. L’existence d’IST associées à la gonococcie était une information manquante pour 54% des cas. Lorsque cette information était disponible, 32% des hommes et 59% des femmes étaient infectés par une autre IST ; il s’agissait principalement d’une co-infection par Chlamydia (19% des hommes et 48% des femmes pour lesquels l’information sur les co-infections était disponible). Le pays probable de contamination était une information manquante pour 72% des cas. Lorsque cette information était disponible, la contamination avait eu lieu hors de France pour 7% des hommes et 3% des femmes. La notion de partenaire infecté n’était pratiquement jamais renseignée par les laboratoires (94% de valeurs manquantes).
Le site anatomique prélevé chez les hommes était principalement urétral ou urinaire (90%), beaucoup plus rarement anal (8% sur l’ensemble de la période d’étude, en diminution ces dernières années : 4% en 2012) ou pharyngé (1%). Chez les femmes, le prélèvement était principalement cervico-vaginal (90%), beaucoup plus rarement urétral ou urinaire (5%) ou anal (1%).
Les patients avaient consulté principalement dans le secteur privé en ville ou en clinique (67% des hommes et 41% des femmes pour lesquels l’information était disponible), plus rarement dans une structure spécialisée de type Centre d’information, de dépistage et de diagnostic des IST (Ciddist), Consultation de dépistage anonyme et gratuit (CDAG) ou Centre de planification et d’éducation familiale (CPEF) (15% des hommes et 32% des femmes) ou dans le secteur hospitalier (17% des hommes et 25% des femmes). Le médecin prescripteur était le plus souvent un généraliste (71% des hommes et 39% des femmes pour lesquels l’information était disponible), un gynécologue (50% des femmes) ou un dermato-vénérologue (11% des hommes et 3% des femmes).
Enfin, les prélèvements bactériologiques avaient été réalisés principalement dans des laboratoires privés de ville (74% des hommes et 62% des femmes), moins fréquemment dans un laboratoire hospitalier (22% des hommes et 34% des femmes) et rarement au sein d’un dispensaire (4% des hommes et des femmes). On entend par dispensaire une structure publique extrahospitalière qui dispose d’un plateau technique biologique (il s’agit en général d’un laboratoire départemental).
Évolution de la sensibilité des souches de gonocoque aux antibiotiques (tableau 2)
L’analyse a porté sur les 8 649 souches de gonocoque testées par le CNR. Les souches ont pu être remises en culture plus fréquemment pour les prélèvements effectués chez les hommes, et pour les prélèvements anaux par rapport aux autres sites anatomiques.
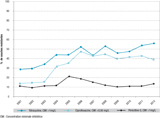
La majorité des souches présentait une sensibilité diminuée à la pénicilline G. La proportion de souches résistantes à la pénicilline a fluctué entre 10 et 21% (figure 2 ; 13% en moyenne) pendant la période d’étude (13,5% en 2012, intervalle de confiance (IC) à 95%:[11,6-15,7]), dont les trois-quarts sont des résistances plasmidiques de haut niveau (tableau 2).
La proportion de souches résistantes à la tétracycline a augmenté, passant de 29% en 2001 à 56% en 2012 (figure 2). En 2012, 33% des souches (IC95%:[31-36]) avaient une résistance chromosomique de bas niveau et 22% (IC95%:[20-25]) une résistance plasmidique de haut niveau.
La proportion de souches résistantes à la ciprofloxacine a fortement augmenté entre 2001 (14%, dont 6% de résistance de haut niveau) et 2006 (47%, dont 43% de résistance de haut niveau), puis est restée élevée autour de 42% (figure 2). En 2012, 1,7% (IC95%:[1,0-2,7]) des souches avaient une résistance de bas niveau et 37% (IC95%:[35-40]), une résistance de haut niveau.
 Agrandir l'image
Agrandir l'image
Aucune souche résistante à la spectinomycine n’a été détectée pendant la période d’étude. Le changement d’E-test à partir de mai 2011 ne permet pas de comparer l’évolution de la distribution des CMI avant et après cette date pour cet antibiotique. Cependant, la CMI médiane entre 2001 et avril 2011 est restée relativement stable (6 à 8 mg/L). De même, la CMI médiane est restée stable entre mai 2011 et décembre 2012 (16 mg/L).
La proportion de souches résistantes au céfixime était inférieure à 1% jusqu’en 2011. Elle était de 0,7% en 2011 (IC95%:[0,3-1,2]) et a significativement augmenté à 3,0% en 2012 (IC95%:[2,1-4,2] ; p<0,001). Les valeurs hautes de CMI (≥0,125 mg/L) ont augmenté régulièrement entre 2008 et 2012 (figure 3).
En 2010, pour la première fois, 2 souches sur 1 400 (0,14%, IC95%:[0,02-0,57]) avaient une résistance à la ceftriaxone (il s’agissait dans les deux cas de prélèvement urétraux chez des hommes) mais aucune en 2011 et 2012. La tendance à la hausse des CMI entre 2008 et 2010 ne s’est pas poursuivie en 2011-2012 (figure 4).
Enfin, les souches multirésistantes étaient exceptionnelles entre 2001 et 2011 (5 sur 3 953, soit 0,1% ; IC95%:[0-0,3]), mais leur nombre a significativement augmenté en 2012 (18 sur 1 093, soit 1,6% ; IC95%:[1,0-2,6] ; p<0,001).
L’analyse restreinte aux seuls laboratoires qui ont poursuivi la surveillance microbiologique en 2012, aboutit à des résultats similaires quant à l’évolution de la sensibilité des souches aux antibiotiques de 2001 à 2012 (données non présentées).
 Agrandir l'image
Agrandir l'image
 Agrandir l'image
Agrandir l'image
Facteurs associés à la baisse de sensibilité des souches de gonocoque aux C3G chez les patients de 15 ans et plus
La baisse de sensibilité au céfixime (CMI≥0,094 mg/L) et à la ceftriaxone (CMI≥0,032 mg/L) était plus fréquente en l’absence d’IST associées à la gonococcie, notamment en l’absence de co-infection par Chlamydia (p<0,01 pour les 2 antibiotiques, analyse univariée).
L’analyse multivariée (tableau 3) a été faite en reprenant les variables du tableau 1. La proportion de souches ayant une sensibilité abaissée pour le céfixime était en augmentation ces trois dernières années ; elle était 2,7 fois plus fréquente en 2012 que pour la période 2001-2009. Cette sensibilité abaissée augmentait avec l’âge des patients. Elle était près de 4 fois plus fréquente pour les souches pharyngées que pour les souches urétrales, y compris lorsque l’analyse a été restreinte aux seuls patients masculins (odds ratio ajusté 4,17 ; IC95%:[1,50-11,60] ; p=0,006). Enfin, la baisse de sensibilité au céfixime était plus fréquente dans l’interrégion Nord-est.
La proportion de souches ayant une sensibilité abaissée pour la ceftriaxone était en augmentation ces trois dernières années, et cette augmentation était particulièrement nette en 2010. En prenant 2010 comme année de référence, la proportion de souches avec une sensibilité abaissée à la ceftriaxone a significativement diminué en 2011-2012. Comme pour le céfixime, cette sensibilité abaissée augmentait avec l’âge des patients, était plus fréquente pour les souches pharyngées (y compris en restreignant l’analyse aux patients masculins : odds ratio ajusté 3,35 ; IC95%:[1,36-8,21] ; p=0,008) et était plus fréquente dans l’interrégion Nord-est.
L’analyse multivariée sur la période 2001-2012, restreinte aux seuls laboratoires qui ont poursuivi la surveillance microbiologique en 2012, aboutit à des résultats similaires (données non présentées).
 Agrandir l'image
Agrandir l'image
Discussion
Au sein du réseau Rénago, on observe une augmentation du nombre de gonococcies déclarées au cours de la période 2001-2012. Plusieurs phénomènes intriqués contribuent à ce constat : l’accroissement réel des infections, la montée en charge de la détection par TAAN, l’augmentation du nombre de laboratoires participants et le mouvement croissant de regroupement des laboratoires. En dépit de cette évolution complexe, le réseau Rénago permet de suivre la résistance du gonocoque aux antibiotiques. Cette surveillance microbiologique paraît fiable car les modifications de fonctionnement du réseau n’ont a priori pas ou peu d’impact sur la proportion de souches résistantes. L’analyse restreinte aux laboratoires qui ont poursuivi la surveillance microbiologique en 2012 est un argument important allant dans ce sens.
La proportion de souches résistantes a fluctué autour de 13% pour la pénicilline G, a augmenté pendant toute la période d’étude jusqu’à 56% en 2012 pour la tétracycline, et a augmenté jusqu’en 2006 puis est restée élevée autour de 42% pour la ciprofloxacine. Ces trois familles d’antibiotiques ont un niveau de résistance qui ne permet pas de les utiliser en pratique courante pour le traitement des gonococcies. En effet, selon l’Organisation mondiale de la santé (OMS), le traitement de première intention doit guérir au moins 95% des patients et ne doit pas être utilisé lorsque plus de 5% des souches sont résistantes 2. La sensibilité du gonocoque à la spectinomycine reste intacte ; cet antibiotique est de nouveau commercialisé en France mais les échecs thérapeutiques en cas de localisation pharyngée en font un traitement de deuxième intention, en cas de contre-indication aux β-lactamines 13.
La proportion de souches résistantes au céfixime (CMI>0,125 mg/L) reste modérée, inférieure à 5%, mais elle a quadruplé entre 2011 et 2012. En outre, les valeurs hautes de CMI augmentent régulièrement ces dernières années (figure 3 et tableau 3). Parallèlement, seules 2 souches résistantes à la ceftriaxone ont été détectées, toutes deux en 2010, dont l’une était associée à un échec thérapeutique du céfixime chez un patient infecté en France 14. Pour la ceftriaxone, les valeurs hautes des CMI n’ont pas augmenté ces deux dernières années. Ces données de surveillance, le caractère encore très exceptionnel des résistances à la ceftriaxone 14,15,16,17,18 et les échecs thérapeutiques décrits avec le céfixime au Japon, au Canada et en Europe 14,19,20,21,22, confortent les recommandations de l’Agence française du médicament publiées en 2005 11 et réitérées en 2008 13 d’utiliser la ceftriaxone (500 mg en une injection unique) en première intention, et de réserver le céfixime (400 mg en une prise orale unique) en cas de refus ou d’impossibilité de traitement parentéral.
Cependant, l’augmentation de la résistance du gonocoque au céfixime observée en France suggère que des cliniciens continueraient de prescrire ce médicament en première intention. Une enquête réalisée en 2008 auprès des médecins généralistes du Réseau Sentinelles® avait montré que seule une minorité de prescripteurs connaissait la recommandation faite en 2005 d’abandonner la ciprofloxacine au profit des C3G 23. Par analogie, on peut supposer qu’en 2012 les médecins n’appliquaient pas suffisamment la recommandation réitérée en 2008 13. Une nouvelle étude sur les prescriptions des médecins permettrait d’étayer cette hypothèse.
Les niveaux de résistance aux antibiotiques en France sont plus élevés que ceux retrouvés aux États-Unis en ce qui concerne la pénicilline G, la tétracycline et la ciprofloxacine, mais du même ordre de grandeur pour les C3G et les multirésistances 24. En revanche, les niveaux de résistance en France sont du même ordre de grandeur que ceux de l’ensemble de l’Europe pour la pénicilline G et la ciprofloxacine mais moins élevés pour les C3G 25.
Nous ne disposons pas actuellement de données sur la sensibilité du gonocoque vis-à-vis de l’azithromycine. En France, cet antibiotique est utilisé à la dose de 1 g en prise orale unique, en association à la ceftriaxone, dans le traitement probabiliste des urétrites et cervicites pour une possible infection associée à Chlamydia trachomatis 11,13. Ailleurs, notamment aux États-Unis, l’azithromycine est recommandée en monothérapie pour les gonococcies en cas d’allergie aux C3G, à la dose de 2 g en une prise 26. Enfin, les recommandations européennes évoquent la possibilité d’utiliser la ceftriaxone à la dose de 1 g associée à l’azithromycine à la dose de 2 g en une prise, en cas de souche résistante aux C3G 1. Compte tenu de l’apparition de résistances à l’azithromycine observée dans certains pays 24,27, cet antibiotique est testé depuis 2013 au sein du réseau Rénago.
Notre étude montre que la proportion de souches ayant une baisse de sensibilité aux C3G augmente avec l’âge des patients, ce qui a déjà été observé pour d’autres antibiotiques (pénicilline et tétracycline) au Canada 27. La proportion plus faible de résistances en cas de co-infection par Chlamydia a également été retrouvée pour le céfixime au Royaume-Uni 28 et pour la ciprofloxacine à l’échelle de l’Europe 25, sans que la raison en soit clairement établie.
La proportion de souches ayant une sensibilité abaissée aux C3G ne diffère pas significativement selon le sexe. Les souches anales ne présentent pas de baisse de sensibilité plus fréquente par rapport aux autres localisations. En revanche, la proportion de souches pharyngées ayant une sensibilité abaissée aux C3G est 3 à 4 fois plus fréquente que pour les autres localisations. Ceci pourrait s’expliquer par le transfert de gènes de mutation associés à la baisse de sensibilité aux C3G à partir de Neisseria commensales du pharynx 29. Les gonococcies anales et pharyngées chez l’homme ont vraisemblablement été acquises, dans la plupart des cas, par transmission homosexuelle, bien que l’absence d’informations comportementales au sein du réseau Rénago ne nous permette pas d’être formels. Plusieurs études ont montré que les HSH sont susceptibles d’être infectés plus fréquemment ou plus précocement par des souches résistantes de gonocoque par rapport aux personnes hétérosexuelles 24,28,30, ce qui incite à une surveillance particulière de la sensibilité des germes chez les HSH. En l’absence de données comportementales, notre étude montre qu’une surveillance renforcée des souches pharyngées vis-à-vis des C3G est primordiale, alors que les souches anales et urétrales apportent des informations équivalentes.
Enfin, nous observons une plus forte proportion de baisse de sensibilité dans l’interrégion Nord-est. L’interprétation en est incertaine mais incite à rester vigilant sur cette région, tout en gardant une répartition géographique homogène du réseau des laboratoires sur l’ensemble du territoire.
La surveillance des résistances du gonocoque à travers le réseau Rénago comporte plusieurs limites. Les départements ultramarins ne sont pas encore impliqués dans cette surveillance. Par ailleurs, les laboratoires participant au réseau ne constituent pas un échantillon représentatif des laboratoires de métropole ; l’extrapolation des résultats nécessite donc des investigations complémentaires. Enfin, ce réseau ne collecte pas de données comportementales dans la mesure où les biologistes n’ont souvent pas accès à ces informations ; ceci explique aussi la fréquence des valeurs manquantes pour certaines variables.
L’émergence de résistances aux C3G est extrêmement préoccupante dans la mesure où elles représentent la dernière ligne de traitement, sans alternatives thérapeutiques actuellement crédibles 29. Ceci justifie à l’échelon collectif de poursuivre la surveillance microbiologique du gonocoque afin d’ajuster les recommandations thérapeutiques. Face à la montée en charge de la détection par TAAN, il est indispensable que les laboratoires d’analyses de biologie médicale continuent de réaliser des cultures pour adapter la prise en charge individuelle des patients, en attendant que soient développés et accessibles des tests moléculaires de sensibilité aux antibiotiques 2. Enfin, une surveillance des échecs thérapeutiques aux C3G est en cours d’établissement à l’échelon européen 31.




