Portage digestif d’entérobactéries résistantes aux céphalosporines de 3e génération et productrices de bêta-lactamase à spectre étendu (BLSE) chez les enfants fréquentant les crèches collectives des Alpes-Maritimes en 2012
// Faecal carriage of third-generation cephalosporin-resistant and extended spectrum beta-lactamase (ESBL)-producing Enterobacteriaceae among children attending day-care centres in 2012 in the Alpes-Maritimes area (France)
Résumé
Les entérobactéries résistantes aux céphalosporines de 3e génération (C3G-R) et productrices de bêta-lactamase à spectre étendu (BLSE), initialement considérées comme strictement nosocomiales, sont aujourd’hui de plus en plus souvent isolées au sein de la communauté. Peu d’études de portage ont été réalisées chez l’enfant, notamment dans les crèches collectives, où l’exposition fréquente aux antibiotiques pourrait le favoriser.
Des prélèvements de selles réalisés entre janvier et avril 2012 chez 419 enfants dans 25 crèches collectives des Alpes-Maritimes ont révélé un taux de prévalence de 11,2% d’entérobactéries C3G-R et de 6,7% de BLSE. Une diffusion clonale était constatée dans une crèche. Un âge inférieur à 24 mois et un traitement antibiotique dans les trois mois précédents étaient associés au portage d’entérobactéries C3G-R.
Le portage de BLSE n’épargne pas les jeunes enfants fréquentant les crèches, lesquels constituent un réservoir potentiel de ces souches.
Abstract
Enterobacteriaceae resistant to third-generation cephalosporins (3GC-R) and producing extended spectrum beta-lactamase (ESBL) that were initially considered to be only acquired in the hospital setting, are now increasingly isolated within the community. Few studies have reported carriage among children, particularly among those attending day-care centres (DCC) where frequent exposure to antimicrobial treatment may be a risk factor.
Faecal samples were collected between January and April 2012 amongst 419 children attending DCCs in the Alpes-Maritimes area (France), 11.2% of them carried 3GC-R isolates and 6.7% carried ESBL isolates. Clonal spread of a unique strain was observed in one DCC. Age less than 24 months and antibiotic treatment in the last 3 months were associated with 3GC-R carriage.
Carriers of ESBL-producing Enterobacteriaceae include children attending day-care centres who may constitute a reservoir for such strains.
Introduction
L’émergence de la résistance bactérienne menace l’efficacité des traitements antibiotiques. Chez les enfants fréquentant les crèches collectives des Alpes-Maritimes, la prévalence du portage rhinopharyngé de pneumocoques de sensibilité diminuée à la pénicilline était comprise entre 17% et 38% au cours d’enquêtes transversales menées tous les deux ans depuis 1999 1. La prévalence du portage digestif de bactéries résistantes, notamment productrices de bêta-lactamase à spectre étendu (BLSE) a été peu étudiée chez les enfants de cet âge, alors que le signalement de détections et d’infections dues à de telles bactéries est en augmentation dans le monde entier et en particulier en France 2,3,4. C’est pourquoi l’enquête de portage rhinopharyngé de pneumocoques chez ces enfants, réalisée en 2012, a été associée à l’étude du portage digestif de bactéries résistantes aux céphalosporines de 3e génération (C3G-R) afin d’en estimer la prévalence et d’explorer d’éventuels facteurs de risques. Parmi celles-ci, les bactéries productrices de BLSE ont fait l’objet d’une identification par biologie moléculaire qui a déjà révélé une émergence microbiologique inédite 5. L’étude des facteurs de risque de portage de l’ensemble de ces entérobactéries résistantes fait l’objet du présent travail, dont les principaux résultats sont présentés dans cet article.
Méthode
S’agissant d’une étude ancillaire adjointe à une 6e enquête de portage de pneumocoques, selon la même méthodologie et devant inclure 25 crèches collectives des Alpes-Maritimes accueillant chacune un minimum de 22 enfants âgés de 0 à 4 ans présents plus de 3 jours par semaine, le tirage au sort des crèches a été commun aux deux enquêtes. Il a été effectué selon la méthode des effectifs cumulés d’enfants, à partir d’une liste communiquée par le Conseil général des Alpes-Maritimes. Pour optimiser les chances de recueillir un échantillon de selles émises le jour de l’enquête, la participation a été proposée à tous les enfants des crèches tirées au sort.
Après obtention du consentement parental, un prélèvement unique de selles a été effectué par enfant. Un questionnaire soumis aux parents recherchait une prise d’antibiotique dans les trois derniers mois, notamment de céphalosporines de 3e génération (C3G), une hospitalisation datant de moins de trois mois, un séjour dans un pays de haute prévalence d’entérobactéries résistantes (Asie, Afrique, Amérique du Sud et Europe de l’Est et du Sud), et la présence d’un animal domestique au foyer.
Taille de l’échantillon
Les données de prévalence du portage de BLSE en milieu communautaire en France au moment de l’élaboration du protocole faisaient état d’un taux de portage de 4,2% en 2009 6. Dans l’hypothèse d’un taux de prévalence analogue dans notre population d’enfants en crèche, un échantillon de 500 enfants devait autoriser une précision de 2,4% au risque α de 5%.
Microbiologie
Dans un délai de moins de 24 heures, chaque prélèvement a été mis en culture sur gélose pour sélection de bactéries résistantes aux C3G (ChromID™ ESBL agar, bioMérieux). Les colonies obtenues ont été identifiées par le système Vitek 2® (bioMérieux) et les colonies productrices de BLSE confirmées par test de synergie en double disque. La sensibilité des souches aux antibiotiques a été déterminée selon les critères définis par le Comité de l’antibiogramme de la Société française de microbiologie.
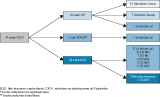
L’étude des mécanismes de résistance et la caractérisation moléculaire des BLSE et des souches de E. coli productrices de BLSE ont été réalisées ensuite : type d’enzyme produite (CTX-M), plasmide porteur de la BLSE, groupe phylogénétique, profil ERIC-2, séquence type (ST) et sérotype. Ce travail a permis de catégoriser les souches, les comparer, les différencier ou confirmer leur caractère clonal, et a fait l’objet d’une publication récente 5.
Analyse statistique
Les données ont été analysées à l’aide des logiciels SAS et SPSS©. La population a été décrite pour l’âge, le sexe, la consommation d’antibiotiques ainsi que pour les prévalences de portage par les effectifs et proportions (intervalles de confiance à 95%). Les analyses univariées recherchant une association entre portage digestif de bactéries résistantes et facteurs de risques potentiels ont fait appel au test du Chi2 ou au test exact de Fisher pour les effectifs <5, au seuil de 5%. Les facteurs associés au portage de bactéries C3G-R et/ou de BLSE en analyse univariée avec une probabilité inférieure à 0,20 ont été inclus dans un modèle multivarié.
Résultats
De janvier à avril 2012, 419 enfants âgés de 4 à 38 mois ont été prélevés dans 25 crèches (parmi les 110 établissements répondant aux critères) réparties sur l’ensemble du département, représentant une capacité d’accueil journalière totale de 1 396 enfants et un effectif moyen de 56 enfants (étendue : 30-100). Le taux de participation global a été de 30%. Les caractéristiques démographiques des enfants sont décrites dans le tableau 1.
 Agrandir l'image
Agrandir l'image
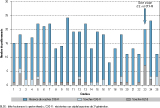
Quarante-sept enfants (11,2% ; IC95%:[8,4-14,7]) étaient porteurs chacun d’une souche C3G-R ; 28 enfants (6,7% ; IC95%:[4,6-9,6]) étaient porteurs d’une souche productrice de BLSE (27 E. coli ; 1 Klebsiella pneumoniae). La distribution dans les crèches du nombre d’enfants prélevés, d’enfants porteurs de souches C3G-R et d’enfants porteurs de souches productrices de BLSE est présentée figure 1. Sur l’ensemble des crèches étudiées, 92% étaient concernées par l’identification d’enfants porteurs de bactéries C3G-R, et 64% par celle d’enfants porteurs de bactéries productrices de BLSE.
 Agrandir l'image
Agrandir l'image
L’identification des espèces, le mécanisme de résistance et le type de BLSE sont décrits figure 2.
 Agrandir l'image
Agrandir l'image
Dans une crèche (crèche n° 23), dans laquelle 20 enfants ont été prélevés, les 7 isolats C3G-R étaient tous des souches d’E. coli productrices de BLSE, isolées parmi les 10 enfants âgés de moins de 24 mois. Cette crèche, située en zone urbaine, accueille 80 jeunes enfants. Sur les 7 enfants, 5 avaient reçu un traitement antibiotique au cours des trois derniers mois. Les souches portées par ces enfants étaient identiques pour l’ensemble des critères de caractérisation en biologie moléculaire : type d’enzyme produite (CTX-M-15), plasmide porteur de la BLSE (IncF F2:A1:B-), groupe phylogénétique (B2), profil ERIC-2 (XIII), séquence type (ST131) et sérotype (O25b:H4). À l’inverse, dans chacune des quatre autres crèches dans lesquelles plus d’un enfant prélevé était porteur, les souches étaient toutes différentes.
En excluant la crèche où circulait une souche clonale, le taux de prévalence de BLSE observé était de 5,2% (IC95%:[3,4-8,1]).
L’analyse des associations du portage de bactérie C3G-R et BLSE avec des facteurs de risques potentiels est présentée dans le tableau 2, qui porte sur la population avec et sans la crèche n° 23 du fait de la particularité de cette dernière, précédemment décrite : une souche commune à l’ensemble des enfants porteurs.
 Agrandir l'image
Agrandir l'image
Parmi les 407 enfants (97,2%) dont les parents ont rempli le questionnaire, 165 (40,5% ; IC95%:[35,8-45,5]) avaient reçu au moins un traitement antibiotique par voie générale dans les trois mois précédents. Dans 41,2% des cas, il s’agissait d’une C3G.
Le portage de souches C3G-R était plus élevé parmi les enfants âgés de moins de 24 mois (p<0,01) et ceux ayant été traités par antibiotique (p<0,02). Les mêmes tendances s’observent en excluant la crèche où existait une diffusion clonale.
Ni les antécédents d’hospitalisation, ni les voyages dans des pays à fort taux de prévalence, ni la présence d’un animal au foyer ne sont apparus comme des facteurs favorisant le portage de souches C3G-R ou BLSE.
Une analyse multivariée a été réalisée pour le portage des souches C3G-R, en prenant dans le modèle les variables associées en analyse univariée avec un p<0,2 (âge, prise de traitement antibiotique dans les trois mois précédant l’étude et présence d’un animal au foyer) et en excluant la crèche n° 23 du fait de sa particularité. Dans ce modèle complet, la présence d’un animal au foyer n’était pas associée au portage (p=0,22) ; aussi, le modèle final a été réalisé sans cette dernière donnée et montre les mêmes tendances qu’en analyse univariée avec une association à la limite de la significativité entre le portage de souches C3G-R et la prise de traitement antibiotique (OR 1,85 ; IC95%:[0,97-3,51] ; p=0,06), et l’âge inférieur à 24 mois (OR 2,21 ; IC95%:[1,06-4,63] ; p=0,03).
Cette analyse n’a pu concerner le portage de BLSE en raison des faibles effectifs.
Discussion
Cette enquête a révélé la présence de bactéries résistantes aux C3G et de bactéries sécrétrices de BLSE chez les enfants fréquentant les crèches collectives du département des Alpes-Maritimes, ainsi que leur transmission au sein d’une crèche en particulier.
L’identification d’enfants porteurs de souches C3G-R dans toutes les crèches sauf deux, et de souches productrices de BLSE dans 64% d’entre elles, suggère l’universalité du phénomène dans cet environnement De plus, hormis la souche identique portée par plusieurs enfants dans une même crèche, les autres souches étaient toutes différentes.
La présence de cette souche très spécifique chez l’ensemble des 7 enfants porteurs, parmi les 20 enfants prélevés, témoigne d’une diffusion clonale. Il pourrait s’agir d’une transmission manuportée entre enfants, très difficile à éviter chez les plus jeunes, ou entre enfants et adultes. On peut faire l’hypothèse que la prise d’antibiotique chez 5 des 7 enfants porteurs de cette crèche (dont deux traités par C3G) a exercé une pression de sélection et favorisé une concentration importante de E. coli ST131 producteurs de CTX-M-15 dans leur tube digestif, forte concentration qui facilite la transmission croisée de cette souche 7. Par ailleurs, la transmission de ces souches en milieu communautaire et intra-familial est documentée dans la littérature, faisant l’objet d’une revue récente 7.
Les taux de prévalence de C3G-R et BLSE observés semblent plus élevés que ceux rapportés dans la littérature scientifique. Une étude, réalisée en 2010 chez 312 enfants âgés de 11 à 39 mois gardés en crèche en Suède, avait mis en évidence un taux de prévalence de BLSE de 2,9% et une diffusion clonale dans deux établissements 8. Nous ne pouvons exclure la possibilité d’une diffusion clonale au sein des autres crèches ayant participé à notre étude puisque nous n’avons pas prélevé la totalité des enfants. Cependant, dans une étude réalisée en France chez des enfants âgés de 6 à 24 mois consultant en pédiatrie libérale, ce taux était déjà de 4,6%, sans que le mode de garde en collectivité ne constitue un facteur de risque 9.
Un traitement antibiotique reçu dans les trois derniers mois était associé au portage d’isolats C3G-R dans l’analyse comprenant la crèche n° 23. En excluant cette dernière, la même tendance persiste. Par ailleurs, aucune influence de la consommation de C3G n’a été objectivée sur le portage de souches C3G-R, ni sur l’ensemble des crèches, ni en excluant la crèche n° 23. Contrairement à ce qui a été observé lors de l’étude rapportée par Birgy et al. 9, aucune association n’a été identifiée avec le portage de BLSE sur l’ensemble des crèches, mais le faible effectif de porteurs, rendant irréalisable l’analyse multivariée, ne permet pas de conclure à ce sujet.
En dehors de la prise de C3G, des publications font état de contacts avec des animaux domestiques et de voyages dans des pays à fort taux de prévalence comme facteurs favorisant l’acquisition de ces souches 10,11,12. Ainsi, une enquête auprès de 230 adultes volontaires participant à un symposium en Allemagne révélait un taux de prévalence de 3,5% et une association avec la présence d’un animal au foyer et avec un voyage vers la Grèce, l’Afrique du Sud ou l’Égypte 11. Aucun de ces facteurs n’a pu être objectivé comme tel dans notre étude.
Notre travail, restreint à un département limitrophe d’un pays à fort taux de prévalence, ne prétend pas refléter l'épidémiologie de ce portage dans les crèches collectives de l’ensemble du territoire français 2. La notion de séjour à l’étranger se heurte à la difficulté de préciser à la fois les destinations exactes, les dates et les durées de séjour. La recherche de contacts avec des personnes porteuses, ayant reçu des C3G et/ou ayant séjourné dans des pays à fort taux de prévalence, n’a pas été réalisée.
Conclusion
Cette enquête confirme l’existence d’un réservoir communautaire de ces entérobactéries C3G-R, qui concernent également les très jeunes enfants. Elle met l’accent sur le risque additionnel d’une diffusion horizontale favorisée par leurs contacts rapprochés, justifiant une surveillance attentive et des mesures d’hygiène renforcées pour en limiter la transmission. Malgré l’absence d’association entre le portage de BLSE et la prise d’antibiotiques dans notre étude, la pression de sélection exercée par ces derniers, en particulier les C3G, incite à poursuivre les efforts pour limiter leur utilisation, notamment chez l’enfant.
Remerciements
Les auteurs remercient : les parents ayant autorisé la participation de leurs enfants à l’enquête ; le personnel des crèches ; le personnel du Service de biologie du CH d’Antibes ; le Dr Mai-Ly Durant et Mme Marie-Agnès Grinneiser du Conseil général des Alpes-Maritimes pour leur assistance lors de la mise en place de l’étude ; le Département de la recherche clinique et de l’innovation du CHU de Nice : Dr Eric Fontas, Mme Sabine Anthony, Mme Christine Boulle, Mlle Stéphanie Baudisson, M. Salim Fakir, Mme Vanina Oliveri, Mme Vanessa Espin.
Ce travail a bénéficié d’un financement dans le cadre du PHRC 2011.




