Le botulisme humain en France, 2013-2016
// Human botulism in France, 2013-2016
Résumé
Le botulisme humain est une affection neurologique rare mais grave, qui fait l’objet d’une déclaration obligatoire depuis 1986 à Santé publique France. Le diagnostic biologique est réalisé par le Centre national de référence (CNR) des bactéries anaérobies et du botulisme (Institut Pasteur, Paris).
Cette étude présente la situation du botulisme humain en France sur la période 2013-2016, à partir des données épidémiologiques de Santé publique France et des investigations biologiques du CNR. Trente-neuf foyers de botulisme confirmés (68 cas) et 3 suspects (4 cas), ont été identifiés : 6 foyers de type A (10 cas), 26 de type B (47 cas), 2 de type F (5 cas) et 5 de type indéterminé (6 cas). Le botulisme alimentaire concernait 36 foyers (6 cas) et le botulisme infantile a été confirmé chez 6 nourrissons. Tous les cas de botulisme alimentaire de type A et F étaient des formes sévères. Deux décès en lien avec une intoxination botulique ont été enregistrés pour cette période.
L’aliment responsable a été identifié dans 15 foyers parmi les 36 foyers de botulisme alimentaire. Il s’agissait majoritairement de produits de charcuterie de préparation familiale ou artisanale, jambon cru notamment, à l’origine de 13 foyers de botulisme de type B dont 3 étaient dus à des charcuteries importées. Des charcuteries de préparation familiale ou artisanale ont été suspectées dans 12 autres foyers. Un pâté de faisan a été mis en cause dans un foyer de type A et une consommation de conserves d’asperges a été suspectée responsable de 2 autres foyers. Un des 2 foyers de botulisme de type F était dû à une viande hachée d’origine industrielle contaminée par Clostridium baratii F7. Aucun aliment n’a été identifié être à l’origine des cas de botulisme infantile, mais une contamination environnementale a été suspectée chez 3 d’entre eux. Une souche de C. botulinum A2 résistante aux pénicillines et au métronidazole a été identifiée dans un cas de botulisme infantile avec rechutes.
Le botulisme reste une pathologie rare en France, mais le maintien de sa surveillance est nécessaire afin d’identifier précocement l’éventuelle émergence d’un nouveau type de toxine ou la mise en cause d’un nouvel aliment, comme dans le cas des 2 foyers de C. baratii type F en 2014 et 2015. La surveillance permet aussi d’identifier rapidement des foyers afin de transmettre sans délai, aux particuliers et aux industriels, les recommandations de modifications de pratiques en termes d’hygiène et de conservation des denrées alimentaires. Enfin, l’identification rapide des aliments contaminés accélère leur retrait du marché ou d’une distribution familiale.
Abstract
Human botulism is a rare but severe neurological disease which is subjected to mandatory declaration since 1986 to Santé publique France. The biological diagnosis is performed by the National Reference Center of Anaerobic Bacteria and Botulism (CNR), Institut Pasteur, Paris.
This study reports the situation of human botulism in France during the 2013-2016 period based on the epidemiological data of Santé publique France and the biological investigations of CNR. Thirty-nine episodes of confirmed botulism and 3 suspected episodes involving 68 and 4 persons, respectively, were identified: 6 type A episodes (10 cases), 26 type B episodes (47 cases), 2 type F episodes (5 cases), and 5 undetermined type episodes (6 cases). The source of botulism was foodborne in 36 outbreaks (66 cases) and 6 cases were infant botulism. All type A and F botulism cases were severe forms including two deaths over this period.
The incriminated food was identified in 15 of the 36 episodes of foodborne botulism. Homemade preparations of pork meat, notably raw ham, were responsible for 13 type B episodes, including 3 due to imported meat. Homemade pork meat was suspected in 12 other outbreaks. Other incriminated foods included pheasant pie and home canned asparagus. One of the two type F episodes was caused by industrial ground meat contaminated with Clostridium baratii F7. No food was identified in infant botulism cases and environmental contamination was suspected in three cases. A penicillin– and metronidazole-resistant C. botulinum A2 strain was isolated from one infant botulism case with relapses.
Human botulism is rare in France. However, botulism surveillance is required for early identification of emerging novel botulinum toxin types, such as in the two C. baratii type F outbreaks in 2014 and 2015. Botulism surveillance also allows addressing recommendations to industrials and consumers regarding hygiene and food preservation practices. Finally, this surveillance allows to quickly identify contaminated food in order to withdraw it from the market or from family’s homes.
Introduction
Le botulisme est une affection neurologique rare mais grave, qui se caractérise par des paralysies flasques descendantes. Elle est due à des neurotoxines botuliques qui sont divisées en sept types (A à G), selon leurs propriétés immunologiques, et en sous-types (actuellement plus de 40 sous-types identifiés), sur la base de leur analogie de séquences d’acides aminés 1. Les Clostridium producteurs de neurotoxines botuliques, C. botulinum et les souches neurotoxinogènes de C. butyricum et C. baratii, sont très hétérogènes d’après leurs caractères phénotypiques, physiologiques et génétiques. Chaque souche produit généralement un seul type de neurotoxine botulique. Ces Clostridium peuvent se développer dans les aliments, notamment ceux qui sont non acides et qui n’ont pas subi de traitement thermique suffisant. La consommation de ces aliments contenant de la toxine préformée est responsable d’une intoxination botulique, cause principale du botulisme alimentaire. Dans certaines conditions, les Clostridium neurotoxinogènes ingérés peuvent se développer dans le milieu intestinal et produire de la neurotoxine in situ. Le botulisme par colonisation intestinale est observé notamment chez les nourrissons (botulisme infantile) et, occasionnellement, chez l’adulte. Le botulisme par blessure est rare. Il résulte, comme le tétanos, d’une contamination de plaie, en particulier chez les toxicomanes injecteurs de drogue.
Cette étude est basée sur les analyses d’identification du botulisme au Centre national de référence (CNR) des bactéries anaérobies et du botulisme (Institut Pasteur, Paris), complétées par les données issues de la déclaration obligatoire à l’Institut de veille sanitaire (InVS, devenu Santé publique France) sur la période 2013-2016. L’objectif est de présenter la situation du botulisme humain en France au cours de la période 2013-2016.
Méthodes
En France, le botulisme est à déclaration obligatoire et, depuis 1986, sa déclaration a été individualisée des autres toxi-infections alimentaires collectives 2,3. Le diagnostic clinique d’un seul cas, même en l’absence de confirmation biologique, doit donner lieu à un signalement immédiat qui permet aux autorités sanitaires (Agences régionales de santé et Directions départementales de la protection des populations) de réaliser une enquête afin d’identifier l’origine de la contamination et mettre en œuvre les mesures de prévention adaptées (retrait d’un aliment contaminé de production familiale, artisanale ou industrielle). Depuis 1998, le CNR des bactéries anaérobies et du botulisme participe à la surveillance du botulisme humain en signalant les cas confirmés biologiquement à l’InVS, et désormais à Santé publique France.
Le diagnostic biologique repose sur la mise en évidence de toxine botulique dans le sérum des malades à l’aide du test biologique chez la souris. La recherche de toxine botulique ainsi que de spores et/ou de formes végétatives de C. botulinum peut être réalisée sur un échantillon de selles, notamment en présence d’une forme de toxi-infection botulique. La détection de C. botulinum est effectuée par culture d’enrichissement et analyse par PCR ciblée sur les gènes codant les neurotoxines botuliques. La bactérie et sa toxine peuvent également être recherchées dans des aliments suspects d’être à l’origine d’intoxinations botuliques.
Résultats
Incidence
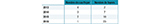
Au cours de la période 2013-2016, 39 foyers de botulisme regroupant 67 cas et 3 foyers suspects (4 cas) ont fait l’objet d’exploration biologique et ont été déclarés aux autorités sanitaires. Une suspicion de botulisme a été portée sur la base de signes cliniques évocateurs de botulisme, malgré des recherches négatives en toxine et C. botulinum dans des échantillons biologiques et alimentaires. Les nombres de foyers et (cas) variaient de 4 (11) à 14 (21), avec une incidence annuelle du botulisme de 0,18/106 à 0,33/106 (figure 1, tableau 1). Ces valeurs sont conformes à celles rapportées depuis 1991 4,5,6,7.
 Agrandir l'image
Agrandir l'image Agrandir l'image
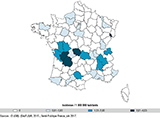
Agrandir l'imageLe plus souvent, le botulisme s’est manifesté sous forme de cas isolés (55%) ou de foyers familiaux de taille limitée (2 à 4 cas) (tableau 2). Les foyers observés étaient distribués dans toute la France (figure 2). Le faible nombre de foyers ne permet pas de délimiter de façon significative des localisations géographiques préférentielles de botulisme. Toutefois, en considérant les cas survenus dans la période 1991-2016, il est à noter une incidence sensiblement plus élevée dans les départements du centre de la France : Vienne (4,0/106), Allier (3,2/106), Indre (2,0/106), Saône-et-Loire (2,0/106) et Creuse (1,9/106).
Parmi les 71 cas, 65 (92%) étaient d’origine alimentaire et 6 étaient des cas de botulisme infantile.
 Agrandir l'image
Agrandir l'imageCaractéristiques des cas
Âge et sexe
Parmi les cas de botulisme alimentaire, 56% étaient des hommes (N=39/65). L’âge médian des cas de botulisme alimentaire était de 41 ans (38 ans chez les hommes, 43 ans chez les femmes). L’âge médian des 6 cas de botulisme infantile était de 3 mois (1 mois-6 mois) et le sexe-ratio H/F était de 2.
Évolution clinique des cas de botulisme alimentaire
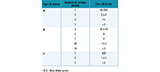
Parmi les 70 patients observés durant la période 2013-2016, les signes cliniques les plus fréquemment rapportés étaient : paralysie oculomotrice (90%), notamment diplopie (55%), paralysie laryngée avec en particulier dysphagie (75%), sécheresse de la bouche et constipation (65 et 59% respectivement). Une paralysie des membres et du diaphragme a été rapportée dans 38% et 28% des cas, respectivement (tableau 3). Les signes digestifs tels que nausées, vomissements, diarrhée ont été observés dans 23 à 33% des cas. Cinquante-quatre cas (75%) ont été hospitalisés, dont 20 (37%) ont nécessité une réanimation avec ventilation assistée. Deux patients (femmes de 85 et 73 ans) sont décédés en 2015 et 2016, en relation avec une intoxination botulique de type A2 et B4 (C. botulinum B non-protéolytique), respectivement.
 Agrandir l'image
Agrandir l'imageSur la période 2013-2016, de nombreuses demandes d’analyses ont concerné le diagnostic différentiel de paralysies flasques, notamment les syndromes de Guillain-Barré et Miller-Fisher et la myasthénie (tableau 1). Ces neuropathies autoimmunes, en particulier le syndrome de Guillain-Barré, se caractérisent par des paralysies flasques ascendantes et des paresthésies, tandis que la paralysie évolue de façon descendante et sans paresthésie au cours du botulisme. Cependant, les signes cliniques de ces affections dans leur phase initiale peuvent prêter à confusion. La confirmation biologique de botulisme est basée sur la mise en évidence de toxine botulique dans le sérum et/ou les selles, et/ou de C. botulinum dans les selles. Une recherche négative dans les autres syndromes est une aide précieuse au diagnostic différentiel.
Types de botulisme alimentaire
Le diagnostic de botulisme a été confirmé pour 39 (93%) des 42 foyers pendant la période. Le typage du botulisme a été réalisé pour 34 foyers (tableau 1). Le type B était largement majoritaire ; il représentait 76% des foyers et 75% des cas confirmés biologiquement, dont un décès. Le botulisme de type A est survenu dans 6 (17%) des foyers confirmés, associé à des formes sévères et à un décès. Le botulisme de type F a été identifié pour la première fois en France en 2014 (1 foyer, 3 cas) et un second foyer (3 cas) est survenu l’année suivante. Aucun cas de botulisme de type E n’a été identifié au cours de cette période. Le typage du botulisme n’a pas été déterminé pour 5 foyers du fait d’un titre en toxine dans les échantillons insuffisant pour interpréter le typage ou d’absence de toxine dans des échantillons tardifs par rapport au début des symptômes. Trois foyers (4 cas) étaient suspects de botulisme sur la base de la symptomatologie, mais ils n’ont pas été confirmés biologiquement. Les cas de botulisme indéterminé ou de suspicion de botulisme présentaient tous des formes cliniques modérées ou frustres.
Explorations biologiques chez les patients atteints de botulisme alimentaire
Parmi les 56 échantillons de sérum de patients avec un botulisme alimentaire (hormis les cas de botulisme infantile, les cas de suspicion et cas de botulisme indéterminé), la toxine botulique a été détectée dans 44 (79%) d’entre eux (tableau 4). Dans la majorité des cas (68%), le titre en toxine botulique était compris entre 1 et 8 doses létales souris (DLS)/ml. Plus rarement (7%), le titre était plus élevé, de 16 à 40 DLS/ml. Chez deux patients, un titre sérique exceptionnellement élevé en toxine botulique a été retrouvé. Il s’agissait d’une patiente tétraplégique en état comateux qui présentait un titre de 400 DLS/ml de toxine botulique F dans le sérum. Cette patiente, hospitalisée en service de réanimation avec assistance respiratoire pendant 11 jours, a eu une issue favorable 8,9. En revanche, la deuxième patiente, qui avait un titre sérique de 40 000 DLS/ml de toxine botulique A, était dans un état de paralysie totale et est décédée au bout de trois semaines suite à des complications infectieuses pulmonaires.
 Agrandir l'image
Agrandir l'imageOrigine alimentaire et exploration des aliments suspects de contamination botulique
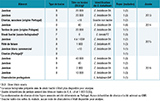
L’origine alimentaire a été confirmée pour 15 foyers (42%) parmi les 36 foyers de botulisme alimentaire. Dans 8 foyers, il s’agissait d’un jambon cru, salé et séché, de préparation familiale ou artisanale. Les titres en toxine botulique dans les échantillons analysés variaient de 40 à 40 000 DLS/g (tableau 5). Un jambon d’origine commerciale était en cause dans un autre foyer et des produits de charcuterie (terrine de porc de préparation familiale et chorizo/charcuteries importés du Portugal) ont été responsables de 4 foyers en 2013, 2015 et 2016 (tableau 5). Tous ces aliments à base de viande de porc ont été responsables de botulisme de type B, et les souches isolées de ces produits étaient de sous-type B4 du groupe II des C. botulinum.
Dans 6 autres foyers de botulisme de type B, avec isolement d’une souche de C. botulinum B4 à partir des selles de patient d’un de ces foyers (tableau 5), et dans 6 foyers supplémentaires suspects de botulisme (12 foyers au total), il y avait une notion de consommation de produits de charcuterie.
Un pâté de faisan de préparation familiale était en cause dans un foyer de botulisme de type A. L’aliment en cause dans les 3 autres foyers de botulisme alimentaire de type A n’a pas été identifié. Dans 2 d’entre eux, les patients avaient consommé des conserves de légumes (haricots verts, asperges) de préparation familiale, mais aucun reste n’était disponible pour analyse. L’aliment responsable du cas dramatique de botulisme de type A survenu en 2016 n’a pas été retrouvé. Il s’agissait d’une personne de 85 ans vivant seule, très alerte jusqu’à la survenue d’un tableau de paralysie flasque très sévère qui a nécessité une hospitalisation en réanimation avec ventilation assistée. Elle présentait en début de maladie un taux extrêmement élevé de toxine botulique A dans le sérum (40 000 DLS/ml) ainsi que dans les selles (1 000 DLS/g). Elle a succombé au bout de trois semaines malgré sérothérapie, échange plasmatique et intubation/ventilation assistée. L’enquête a montré la notion d’une consommation d’un plat sous vide de cannelloni périmé depuis 15 jours, mais aucun reste n’était disponible pour analyse. Les autres aliments à risque retrouvés dans le réfrigérateur de la patiente (pâté de canard à l’échalote, saucisson sec, rillettes de canard, graisse de canard, beurre doux, lait de chèvre d’origine commerciale) n’ont pas révélé la présence de toxine botulique ni de C. botulinum.
L’origine alimentaire a été déterminée pour un des 2 foyers de botulisme dus à C. baratii F7. Trois personnes avaient pris un repas dans un restaurant dans la même tranche horaire et y avaient consommé une sauce bolognaise 10. C’était le seul plat à avoir été consommé en commun par les trois convives. Cette sauce avait été préparée un ou deux jours auparavant à partir de steak haché congelé d’origine commerciale et C. baratii a été retrouvé dans un échantillon de steak conservé dans le réfrigérateur du restaurant. L’origine du premier foyer de botulisme à C. baratii F n’a pas été déterminée, mais elle était probablement différente de celle du 2e foyer, car les souches de C. baratii F7 des deux foyers présentaient un profil génétique distinct 11 et aucune consommation de viande hachée n’a été rapportée dans le premier foyer.
 Agrandir l'image
Agrandir l'imageBotulisme infantile
Le botulisme infantile, qui résulte d’une colonisation intestinale par C. botulinum et production de toxine botulique in situ, se traduit rarement par la présence de toxine botulique dans le sérum 12. Parmi les 6 cas de botulisme infantile (tableau 6), la toxine botulique a été détectée dans le sérum d’un seul enfant. Les titres en toxine botulique dans les échantillons de selles variaient de 340 à 300 000 DLS/g. Les titres en toxine botulique dans le contenu intestinal fluctuent au cours de la maladie. Ainsi, dans une forme chronique de botulisme infantile en 2013, les titres en toxine botulique A ont oscillé sur une période de 150 jours, avec des valeurs extrêmes de <40 DLS/g à 300 000 DLS/g 13. La souche de C. botulinum A2 identifiée chez cet enfant était résistante aux pénicillines et au métronidazole 13. Il s’agit du premier cas décrit de souche de C. botulinum résistante à des antibiotiques.
Les 6 cas de botulisme infantile au cours de cette période étaient de type A (2 cas) ou de type B (4 cas) (tableau 6). Les souches isolées des selles étaient de type et sous-type variés A2, B2, B5, Bf, mais toutes appartenaient au groupe I (C. botulinum protéolytiques A, B et F).
 Agrandir l'image
Agrandir l'imageL’investigation des aliments connus comme étant à risque et qui avaient été consommés par ces nourrissons n’a pas permis d’identifier l’origine de la contamination. Une contamination directe à partir de l’environnement a été suspectée dans 2 foyers de botulisme infantile pour la période 2013-2016. Le nourrisson qui a développé un botulisme à C. botulinum A2 avec plusieurs rechutes vivait à proximité d’une centrale thermique qui relâchait de la vapeur d’eau ainsi que de la fumée et des poussières de façon intermittente 13. C’est le seul facteur de risque qui a été notifié pour ce cas de botulisme. Un autre nourrisson a contracté un botulisme à C. botulinum B2 alors que des travaux de terrassement étaient effectués près de son domicile. Ce même type et sous-type de C. botulinum a été détecté dans 5 échantillons de sol/poussières de ce chantier (2 à 20 bactéries/g), alors que les investigations pour C. botulinum pour 12 échantillons d’aliments consommés par le nourrisson sont restées infructueuses. Cependant, un clone isolé d’un échantillon de poussières du chantier était d’un fond génétique distinct de celui de la souche isolée des selles du bébé, laissant présager d’une diversité des C. botulinum dans l’environnement, qui reste à définir.
Discussion
En France, le botulisme reste une maladie rare avec 11 à 22 cas annuels (18 en moyenne) survenus dans la période 2013-2016. Cette incidence est comparable à celle de la période précédemment étudiée (1991-2012), malgré des fluctuations d’une année sur l’autre (figure 1). Cependant, c’est une maladie sévère avec 75% des patients hospitalisés, le plus souvent en service de réanimation, et deux décès au cours de cette période. L’incidence du botulisme est probablement sous-estimée du fait de formes cliniques frustres, comme celles se limitant à des troubles visuels passagers et qui ne font pas l’objet d’examens complémentaires, comme déjà mentionné 14.
Le botulisme alimentaire est la forme la plus fréquente en France (85% des foyers et 91% des cas au cours de la période 2013-2016) et concerne majoritairement les adultes. Étant donnée la rareté de cette maladie, la suspicion et le diagnostic de botulisme sont souvent tardifs, malgré parfois des signes cliniques caractéristiques, ce qui entrave l’efficacité du traitement par sérothérapie. En effet, la sérothérapie anti-botulique n’est efficace que si elle est instaurée précocement après l’apparition des symptômes, classiquement dans un délai de 24 heures, et elle est recommandée dans les formes sévères. La notion de consommation d’aliments à risque de botulisme (denrées en conserve, charcuterie) associée à des cas groupés de paralysie flasque (paralysie des muscles de l’accommodation oculaire, paralysie pharyngée, parésie/paralysie des membres, du diaphragme) chez des adultes est évocatrice de botulisme. Les signes digestifs (diarrhée, vomissements) parfois observés en phase initiale d’un épisode botulique alimentaire, ne sont pas dus à la toxine botulique mais à d’autres contaminants de l’aliment 15.
Les produits de charcuterie étaient associés à 70% des foyers de botulisme alimentaire. Dans tous ces foyers, les souches de C. botulinum isolées du produit de charcuterie et/ou des selles des patients étaient de type B sous-type B4. Elles appartiennent au groupe II des C. botulinum, qui regroupe les souches non-protéolytiques capables de se développer à basse température. Les souches de C. botulinum B4 sont très homogènes sur la base de la séquence des gènes codant la neurotoxine et de leurs fonds génétiques, déterminés par séquençage complet du génome 16. Aucun autre type d’aliment n’a été identifié dans les foyers de botulisme alimentaire de type B. Il faut noter que les souches de type B impliquées dans les cas de botulisme infantile étaient du groupe I et de sous-types plus variés (B2, B5, Bf) (tableau 5). Le botulisme de type B associé à la consommation de produits de charcuterie est traditionnellement la forme de botulisme la plus fréquente en France 4,6,7. C. botulinum B est un fréquent commensal du tube digestif des porcs et il peut être véhiculé lors de la bactériémie d’abattage vers les masses musculaires (jambon), s’y développer et produire de la toxine 7. Le titre en toxine botulique est variable selon la localisation dans un jambon. Il est généralement plus élevé au cœur du jambon, plus richement vascularisé et qui constitue la zone initiale de contamination, qu’en périphérie. Malgré le faible nombre de cas de botulisme qui ne permet pas de définir significativement des zones à botulisme, cette maladie, et plus particulièrement le botulisme de type B, est sensiblement plus fréquente dans les départements du centre de la France (figure 2) comme déjà noté pour la période d’étude précédente 1991-2012 7. La consommation traditionnelle de produits de charcuterie de préparation familiale ou artisanale et n’ayant pas subi de traitement thermique suffisant (jambon et autres salaisons) dans ces régions rend probablement compte de cette incidence plus élevée. Le botulisme a été initialement décrit dans le sud de l’Allemagne au début du 19e siècle où il s’est manifesté par de nombreux cas et décès 17. Des produits de charcuterie préparés dans des conditions sanitaires insuffisantes en étaient la cause. L’incidence du botulisme est actuellement extrêmement rare en Allemagne ainsi qu’en Alsace, où la consommation de charcuterie est traditionnelle. L’amélioration des mesures sanitaires dans la préparation des charcuteries, qui est de plus en plus réalisée de façon industrielle avec des contrôles sanitaires adaptés, est certainement responsable de cette baisse d’incidence. Le porc est un réservoir de C. botulinum B, mais la colonisation de son tube digestif par ce pathogène est influencée par les conditions d’élevage. Ainsi, dans une enquête en Suède, la prévalence de C. botulinum B dans les fèces était nettement plus élevée chez les porcs élevés en bâtiment que chez ceux élevés à l’extérieur, et ce plus particulièrement en période hivernale 18. Des différences de mode d’élevage des porcs pourraient aussi rendre compte des variations d’incidence du botulisme humain lié aux produits de charcuterie selon les régions. Le botulisme était également très fréquent dans les pays de l’est de l’Europe (Pologne, Géorgie) en relation avec des charcuteries ou conserves de légumes de préparation familiale. La situation s’est nettement améliorée ces dernières années suite à un meilleur respect des mesures sanitaires dans la préparation des conserves 15. L’Italie est, avec la France, le pays d’Europe de l’Ouest où le botulisme est le plus fréquent (15,5 cas annuels en moyenne, 1986-2015). Il s’agit essentiellement d’un botulisme alimentaire dû à des conserves familiales de légumes dans l’huile ou la saumure 19.
Le botulisme alimentaire de type A (4 foyers) était nettement plus rare dans la période 2013-2016 que dans la période 2010-2012, où il représentait près de la moitié des foyers (11/24) 7. L’origine des foyers de botulisme de type A est plus variée que celle de type B. Souvent, il s’agit d’une contamination de conserves de légumes, comme les asperges (deux foyers) ; dans un autre cas, un pâté de faisan était en cause.
Le fait marquant en matière de botulisme alimentaire au cours de la période 2013-2016 a été la survenue de deux foyers de botulisme de type F à C. baratii F7. Ce sont les deux premiers foyers de ce type rapportés en France 8,10. Un premier foyer d’origine inconnue incluait deux cas, dont un très sévère mais avec évolution favorable. Le deuxième foyer a concerné trois cas et avait pour origine de la viande de bœuf d’origine industrielle utilisée pour la préparation de sauce bolognaise. Ces deux foyers ne semblent pas reliés étant donné les différences de profil génétique des souches de chaque foyer 9,11.
Le botulisme infantile reste rare en France (six cas identifiés entre 2013 et 2016 et neuf cas entre 2004 et 2012) 4,6,7. Cette forme de botulisme reste plus difficile à suspecter, étant donné que les signes de déficit du système neuronal cholinergique peuvent être confondus avec d’autres syndromes se traduisant par de l’apathie ou de la léthargie. Un tableau sévère d’apathie/léthargie associé à de la constipation évoluant sur un mode apyrétique devrait évoquer un éventuel botulisme. Le botulisme infantile est aussi parfois suspecté lors de mort subite inexpliquée du nourrisson. L’absence fréquente de consommation d’aliment à risque renforce la difficulté d’évoquer un botulisme infantile. C’est le cas notamment des nourrissons alimentés exclusivement au sein. Si le miel a été incriminé dans certains cas de botulisme infantile, notamment dans certains États des États-Unis et en Italie, une contamination d’origine environnementale est le plus souvent évoquée 12,20,21,22,23,24,25,26. Le botulisme infantile est la forme la plus fréquente aux États-Unis, avec environ 100 cas par an principalement localisés dans certains États. Au cours de la période récente 2010-2014, aucun des 572 cas américains n’a été lié à une consommation de miel contaminé par des spores de C. botulinum (https://www.cdc.gov/botulism/surveillance.html). En effet, le botulisme infantile peut résulter de l’ingestion d’un très petit nombre de spores (10 à 100) qui peuvent être véhiculés par quelques poussières ou parcelles de terre 27. Ainsi, le botulisme infantile a été associé à des travaux agricoles ou de terrassement à proximité du domicile du nourrisson, au transport de terre contaminée par les chaussures ou bottes de parents agriculteurs, ou bien à des poussières de maison et des conditions venteuses 23,28,29,30,31. Aucun aliment, parmi les 21 analysés dans le cadre des cas de botulisme infantile 2013-2016, n’a révélé la présence de C. botulinum. Cependant, des aliments éventuellement contaminés et consommés par le nourrisson n’étaient plus disponibles pour analyse lors de l’investigation. Pour un des cas de botulisme infantile, C. botulinum type B a été détecté dans cinq échantillons de sol d’un chantier à proximité du domicile du nourrisson, alors que 13 échantillons d’aliments distribués à ce nourrisson ont été testés négatifs en C. botulinum. Il faut souligner un cas de botulisme infantile probablement d’origine environnementale, caractérisé par plusieurs rechutes, qui était dû à une souche de C. botulinum A2 résistante aux pénicillines et au métronidazole. Ce nourrisson avait reçu initialement un traitement antibiotique incluant amoxicilline et métronidazole. Ceci renforce l’intérêt de caractériser les souches de C. botulinum pour adapter une éventuelle antibiothérapie 13. Un autre cas de botulisme infantile avec excrétion prolongée de C. botulinum a été décrit en Finlande, mais sans notion de souche antibiorésistante 32.
Conclusion
Bien que le botulisme soit une maladie rare, il est régulièrement observé en France, le plus fréquemment sous forme de botulisme alimentaire. Le botulisme de type B, occasionné principalement par la consommation de produits de charcuterie contaminés, est le type le plus fréquent en France et se traduit généralement par des formes cliniques modérées. Le botulisme de type A ou F est à l’origine de formes très sévères : deux décès ont été enregistrés au cours de la période 2013-2016. La sévérité du botulisme et sa possible dissémination par des aliments de préparation industrielle justifient le maintien d’une surveillance attentive comprenant une identification rapide et détaillée des foyers, complétée par des recommandations aux particuliers et aux industriels sur les problèmes d’hygiène et de conservation des denrées alimentaires.
Références
(29-30):261-4. http://opac.invs.sante.fr/index.php?lvl=notice_display&id=3941
Rep. 2015;1(1).