Approche et méthodologie générale pour l’estimation des cancers attribuables au mode de vie et à l’environnement en France métropolitaine en 2015
// Overall approach and methodology to estimate cancers attributable to lifestyle and environmental risk factors in metropolitan France in 2015
Résumé
Cet article décrit la méthode utilisée pour estimer la part et le nombre de cancers attribuables à des facteurs de risque liés au mode de vie et à l’environnement chez les adultes en France en 2015.
Treize facteurs ont été étudiés : tabac, alcool, alimentation, surpoids et obésité, activité physique insuffisante, hormones exogènes, durée d’allaitement sous-optimale, infections, radiations ionisantes, pollution atmosphérique, rayonnement solaire (UV), expositions professionnelles, et exposition aux substances chimiques en population générale (arsenic dans l’eau et benzène dans l’air intérieur). Des données d’exposition représentatives de la population française proches de l’année 2005 et des estimations du risque de cancer associé à ces expositions ont été utilisées pour estimer la fraction attribuable (FA) à chaque facteur dans la population âgée de 30 ans et plus, par localisation et par sexe, en supposant un temps de latence de 10 ans entre l’exposition et le risque de cancer. Le nombre de nouveaux cas de cancers estimé en 2015 a été multiplié par les FA pour obtenir une estimation du nombre de cancers attribuables à chaque facteur. Le projet a impliqué plus de 80 collaborateurs appartenant aux principales institutions de recherche et de santé publique françaises, assurant ainsi le consensus institutionnel sur les données et la méthode utilisés, ainsi que sur les résultats et leur interprétation.
L’estimation des FA repose sur des hypothèses fortes (temps de latence de 10 ans, indépendance entre les facteurs de risque étudiés) et elle est limitée par les incertitudes sur les estimations de risque et d’exposition de la population aux facteurs de risque. Elle constitue néanmoins un outil précieux pour la quantification du nombre de cancers évitables en France, indispensable à l’information de la population et à la mise en place de futures actions de prévention ciblées.
Abstract
This article describes the methodology used to estimate the number and the proportion of new cancer cases attributable to lifestyle and environmental risk factors (RF) in adults in France in 2015.
13 RF were included: smoking, alcohol, diet, overweight and obesity, insufficient physical activity, exogenous hormones, sub-optimal duration of breastfeeding infections, ionizing radiation, air pollution, solar radiation (UV), occupational exposures, and exposure to chemicals in general population (arsenic in drinking water and indoor benzene). Exposure data representative of the French population (around 2005) and risk estimates were used to estimate the population attributable fraction (PAF) in adults aged 30 or older, by RF, cancer site and sex, assuming a latency time of 10 years between exposure and cancer occurrence. PAF was multiplied by the estimated number of new cancer cases in 2015 to obtain the estimated number of cancer cases attributable to each RF. The project involved more than 80 collaborators from the major French research and public health institutions, ensuring institutional consensus on the data and method used, results and interpretation.
The PAF estimation is based on strong assumptions (latency time, independence between RF), and is limited by the uncertainties linked to the exposure and risk estimates. Nevertheless, the PAF is a valuable tool to inform the public and to provide an evidence base quantification of the number of avoidable cancer cases in France, which is useful to inform the population and set up future targeted prevention strategies.
Introduction
Le cancer est une cause majeure de morbidité en France, avec 380 000 nouveaux cas estimés en 2015 1,2. Depuis 30 ans, le nombre de nouveaux cas de cancers a doublé et le cancer constitue la cause principale de mortalité en France 3. Pourtant, les études évaluent que 30 à 50% des cancers pourraient être évités en supprimant ou en réduisant l’exposition à des agents cancérogènes 4,5,6. En 2000, le Centre international de recherche sur le cancer (Circ) avait estimé cette proportion à 35% en France 6. La prévention primaire, par la modification du mode de vie et de l’environnement, constitue donc un levier d’action important pour réduire l’incidence du cancer. L’un des objectifs du Plan cancer 2014-2019 est d’ailleurs de réduire de moitié la proportion de cancers évitables au cours des 20 prochaines années (http://www.e-cancer.fr/Plan-cancer/Plan-cancer-2014-2019-priorites-et-objectifs).
Depuis les travaux du Circ sur les causes du cancer en France en 2000 6, la cancérogénicité de nouveaux agents a été établie, l’exposition de la population aux différents facteurs de risque a évolué et de nouvelles données d’exposition de la population française ont été produites. En parallèle, un Baromètre cancer réalisé en 2010 avait montré qu’un tiers des Français considéraient qu’il était impossible de prévenir le cancer. Il était donc nécessaire de mettre à jour les estimations de 2000 sur les causes du cancer en France, afin d’améliorer l’information de la population et des décideurs pour la mise en place de stratégies de prévention ciblées. Une étude a ainsi été conçue pour estimer le nombre de nouveaux cas de cancers observé en 2015 chez les adultes de 30 ans et plus en France métropolitaine, pouvant être attribué à des expositions passées à des facteurs de risque liés au mode de vie et à l’environnement.
Cet article décrit la démarche adoptée et la méthodologie utilisée pour réaliser cette estimation. Le rapport complet de l’étude, disponible sur le site du Circ 7, présente la méthodologie détaillée par facteur de risque. Les résultats sont présentés et discutés en détail dans l’autre article de ce même numéro du BEH 8.
Sélection des facteurs de risque étudiés
Ont été inclus dans l’analyse les facteurs de risque de cancer répondant aux critères suivants :
–être classé certainement ou probablement cancérogène par le Circ (groupe 1 ou 2A) ou, pour les facteurs nutritionnels (alimentation, activité physique), présenter un niveau de preuve convaincant ou probable d’après le World Cancer Research Funds/American Institute for Cancer Research’s Continuous Update Project (WCRF CUP) ;
–être modifiable au niveau de la population par des actions de prévention. Les facteurs de risque constituant des caractéristiques individuelles, comme par exemple la parité et l’âge au premier enfant, n’ont pas été inclus dans l’analyse ;
–disposer de données d’exposition représentatives de la population française ;
–disposer d’estimations de risque fiables pour chaque paire exposition/localisation de cancer, compatibles avec les données d’exposition disponibles.
Données utilisées
Pour réaliser l’estimation des fractions attribuables (FA), les données suivantes ont été recueillies :
–1. La prévalence de l’exposition à chaque facteur de risque et, si nécessaire, la répartition de la population dans les différents niveaux d’exposition.
Les données d’exposition provenaient, par ordre de priorité, d’enquêtes nationales représentatives de la population ou, à défaut, de méta-analyses d’enquêtes de cohortes ou cas-témoins. Lorsque cela était possible, les données d’exposition ont été recueillies par âge et par sexe, et les distributions d’exposition continues ont été préférées aux distributions par catégories. Afin de tenir compte du temps de latence entre l’exposition aux facteurs de risque et le diagnostic de cancer, un intervalle de 10 ans entre les données d’exposition recueillies et l’incidence observée en 2015 a été considéré pour la plupart des facteurs de risque. Les niveaux d’exposition de 2005 (ou autour de 2005) chez les personnes âgées de 20 ans et plus ont été utilisés. Quelques exceptions ont été faites lorsque le risque était connu pour apparaître après un délai d’exposition plus court ou plus long (traitement hormonal de la ménopause ou expositions professionnelles, par exemple). Pour la plupart des facteurs, une prévalence transversale a donc été utilisée ; des exceptions ont été faites pour l’étude des expositions professionnelles et des radiations, pour lesquelles une exposition cumulée a été prise en compte.
–2. L’estimation de la relation entre exposition et risque de cancer, pour chaque paire facteur de risque/localisation cancéreuse. Dans la plupart des cas, il s’agissait d’un risque relatif (RR).
Les estimations de risque provenaient, par ordre de priorité, de méta-analyses, de grandes études de cohortes ou cas-témoins ou, enfin, d’études françaises lorsque cela était pertinent. Les études observationnelles utilisées pour estimer les FA devaient fournir des risques ajustés sur les potentiels facteurs de confusion. Lorsque les fonctions de risque n’étaient pas disponibles pour les catégories d’exposition existantes, elles ont été obtenues par modélisation.
–3. Le nombre de nouveaux cas de cancers par localisation et par sexe observé en France métropolitaine en 2015.
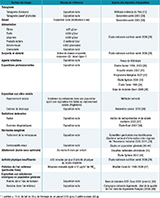
Le réseau Francim des registres de cancers français a fourni les taux d’incidence en 2013 par âge, sexe et localisation de cancer, basés sur 13 registres généraux et 6 registres spécialisés qui couvraient environ 24% de la population (tableau 1) 9. Les codes CIM-O-3 (Classification internationale des maladies pour l’oncologie) fournis initialement ont été convertis en codes CIM-10 (Classification internationale des maladies, 10e révision). Les taux d’incidence observés en 2013 chez les adultes de 30 ans et plus ont été extraits puis extrapolés à la France métropolitaine et appliqués à la population 2015 10, afin d’obtenir une estimation du nombre de nouveaux cas de cancers en France métropolitaine en 2015. Ces estimations sont présentées dans le tableau 2 pour les localisations principales. Ce sont les estimations qui ont été utilisées pour calculer le nombre de cas de cancers attribuables à chaque facteur de risque.
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageDéfinition des niveaux de référence
Pour chaque facteur de risque, un niveau optimal d’exposition a été défini : il s’agit du niveau de référence, qui correspond à l’exposition associée au risque de cancer minimal. Lorsque cela était possible, le niveau de référence était une exposition nulle ; dans le cas contraire, ou pour les facteurs ayant des effets protecteurs sur le risque de cancer, le niveau de référence choisi était celui recommandé pour la population française.
Au total, 13 facteurs de risque ont été inclus dans l’analyse : tabagisme (dont tabagisme passif), consommation de boissons alcoolisées, alimentation, surpoids et obésité, activité physique insuffisante, utilisation d’hormones exogènes (contraceptifs oraux et traitements hormonaux de la ménopause), allaitement (durée sous-optimale), infections, radiations ionisantes, pollution de l’air extérieur, rayonnement solaire (UV), expositions professionnelles (facteurs chimiques, physiques, organisationnels) et exposition de la population générale à l’arsenic dans l’eau de boisson et au benzène dans l’air intérieur, en tant qu’exposition aux substances chimiques en population générale. Pour certains de ces facteurs, des analyses par sous-catégories ont aussi été réalisées (consommation de fibres, fruits, légumes, viande rouge, charcuterie et produits laitiers pour l’alimentation, par exemple).
Une analyse complémentaire du rôle du statut socioéconomique a également été menée, en évaluant le poids du tabac dans les inégalités sociales d’incidence des cancers liés au tabac. Aucune information sur le niveau socioéconomique individuel des personnes n’étant disponible dans les données des registres, la FA liée au tabagisme a été calculée en fonction du niveau socioéconomique de l’Iris de résidence (îlots regroupés pour l’information statistique) en divisant la population en cinq groupes, des 20% les plus défavorisés aux 20% les plus favorisés.
Le tableau 3 présente les facteurs de risque inclus avec, le cas échéant, leurs sous-catégories, le niveau de référence défini pour chacun d’eux et les sources de données utilisées pour estimer la prévalence d’exposition dans la population française. Le tableau 4 présente l’ensemble des paires facteurs de risque/localisation de cancer pour lesquelles une FA a été estimée, et le niveau de preuve correspondant.
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageEstimation des fractions attribuables en population
Les estimations des FA et du nombre de cas de cancers attribuable aux facteurs de risque ont été réalisées seulement pour les adultes de 30 ans et plus en 2015. En effet, la plupart des cancers surviennent après l’âge de 30 ans, et ceux qui surviennent plus tôt présentent des étiologies complexes faisant intervenir des facteurs héréditaires 11.
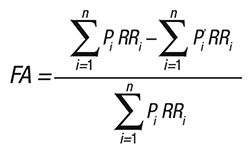
Les FA ont été estimées par localisation de cancer, par sexe et par âge lorsque cela était possible, en appliquant la a formule 1, dans laquelle RR(x) est le risque relatif pour le niveau d’exposition x, P(x) est la distribution de l’exposition dans la population, P’(x) est la distribution de l’exposition de référence (celle ayant le niveau d’exposition correspondant au risque de cancer minimal) et m est le niveau maximum d’exposition. Si des données continues de risque et/ou d’exposition n’étaient pas disponibles, des estimations de la prévalence et des risques par catégories ont été utilisées pour estimer les FA à l’aide de la formule 2, dans laquelle n est le nombre de catégories.
Formule 1
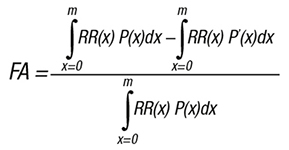
Formule 2
Cette méthode de calcul de la FA a été appliquée systématiquement lorsque cela était possible, afin d’assurer l’homogénéité entre les facteurs de risque et, ainsi, de pouvoir assurer la comparaison des FA estimées pour chacun.
Cependant, pour certains facteurs de risque pour lesquels les données de prévalence d’exposition n’étaient pas ou difficilement disponibles, des méthodes différentes ont été appliquées : pour le tabagisme et l’impact du tabac dans les inégalités sociales pour les cancers liés au tabac, la méthode indirecte de Lopez et Peto a été utilisée, afin de s’affranchir du besoin d’informations détaillées sur l’histoire du tabagisme au long de la vie et des RR correspondants 12. Pour l’exposition aux UV, en l’absence de données sur l’exposition de la population, une méthode indirecte de comparaison avec une population de référence dont l’exposition aux UV est considérée comme très faible a été utilisée (cohorte de naissance de 1903 de South Thames, Angleterre) 13. Enfin, pour les agents infectieux, les estimations sont basées sur la prévalence des infections chez les patients atteints de cancer plutôt que dans la population générale, selon la méthodologie décrite par Plummer et coll. 14.
Dans un premier temps, les FA ont été estimées pour les adultes de 30 ans et plus, pour chaque facteur de risque, par localisation de cancer j et par sexe. Lorsque plusieurs sous-catégories d’un même facteur de risque étaient associées à une même localisation cancéreuse j, la FA combinée pour ce facteur de risque (FAC,j) a été estimée par localisation en utilisant la formule 3, dans laquelle i est le nombre de sous-catégories du facteur de risque. Par exemple, le cancer de la bouche et de la cavité orale était associé aux deux facteurs alimentaires : consommation de fruits inférieure à 300 g/jour et consommation de légumes inférieure à 3s00 g/jour. Une FA combinée pour l’alimentation a donc été estimée pour cette localisation.
Formule 3
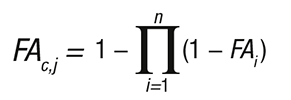
Pour chaque localisation, le nombre de cas de cancers attribuable à chaque facteur de risque a été obtenu en multipliant la FAC,j par le nombre de cas de cancers observé pour cette localisation, par âge et par sexe le cas échéant.
Dans un deuxième temps, étant donné qu’une même localisation de cancer j pouvait être associée à plusieurs facteurs de risque, cette même formule 3 a été utilisée pour estimer les FA combinées entre facteurs de risque, pour une localisation donnée ; i est alors le nombre de facteurs de risque associés à une même localisation.
Organisation générale du projet
Cette étude a été menée par la Section surveillance du cancer (CSU) du Circ à Lyon, en collaboration avec d’autres sections au sein du Circ, avec des agences nationales françaises de santé publique, des instituts et universités françaises et avec le soutien financier de l’Institut national du cancer (INCa).
Un groupe de travail a été formé pour chaque facteur de risque. Ces groupes étaient constitués chacun de deux à huit experts français parmi les plus compétents sur le facteur de risque considéré. Leur rôle était d’apporter un avis et une aide à la décision sur les données d’exposition et de risque utilisées, sur la méthode envisagée ainsi que sur l’interprétation des résultats. Un Comité consultatif international et un Comité de pilotage ont également été mis en place. Le premier était constitué d’experts internationaux dans le domaine des estimations de fractions de cancers attribuables aux facteurs de risque comportementaux ou environnementaux. Son rôle était de fournir un avis scientifique sur les choix méthodologiques et sur les résultats du projet dans sa globalité. Le Comité de pilotage était, quant à lui, constitué de cinq membres issus de grandes institutions de santé publique en France : Inserm, Institut Gustave Roussy, Santé publique France et Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses). Son rôle était de constituer les groupes de travail, d’assurer le suivi du projet et de proposer des actions en cas de difficultés rencontrées. Il a aussi validé les rapports de chaque groupe de travail et vérifié que les méthodes appliquées par chacun étaient suffisamment homogènes pour permettre la comparaison des résultats.
De nombreux autres collaborateurs ont été impliqués ponctuellement dans le projet (extraction de données, contact avec les institutions, observateurs…). Au total, plus de 80 collaborateurs ont travaillé à ce projet.
Discussion
Cette étude avait pour but d’estimer le nombre de cas de cancers observés chez les adultes en 2015 en France métropolitaine, pouvant être attribués à des facteurs de risque modifiables, liés au mode de vie ou à l’environnement. L’analyse repose sur plusieurs hypothèses et comporte certaines limites qu’il convient de souligner.
Population d’étude
Les résultats ne concernent que les adultes de 30 ans et plus, et n’incluent donc pas l’impact des facteurs de risque étudiés sur les cancers apparaissant chez les moins de 30 ans. Le nombre de cas de cancers attribuable aux facteurs de risque a donc été sous-estimé, certaines expositions dans l’enfance (avant l’âge de 20 ans, si on considère un temps de latence de 10 ans) pouvant être responsables de cancers avant l’âge de 30 ans. Néanmoins, l’incidence des cancers avant cet âge étant très faible et ces cancers présentant bien souvent un profil étiologique particulier 11, ne pas les inclure dans l’analyse ne devrait pas avoir influencé de manière significative le nombre total de cancers attribués aux facteurs de risque étudiés.
Facteurs de risque inclus dans l’analyse
L’analyse a été menée sur 13 facteurs de risque de cancer, tous ayant un niveau de preuve élevé. Toutefois, de nombreux autres facteurs de risque de cancer certainement ou probablement cancérogènes n’ont pas été inclus dans l’analyse, dans la plupart des cas faute de données d’exposition ou d’estimation de risque pertinentes pour la population française. C’est le cas notamment de plusieurs substances chimiques de l’environnement auxquelles est potentiellement exposée la population générale, mais pour lesquelles aucune donnée d’exposition représentative de la population française et/ou compatible avec les estimations de risque existantes n’était disponible (exposition au glyphosate dans la population générale, par exemple). Le nombre estimé de cancers attribuables au mode de vie et à l’environnement ne tient donc pas compte de la totalité des facteurs de risque de cancer modifiables auxquels la population est réellement exposée, sous-estimant potentiellement le nombre de cas attribuables. Ce travail souligne donc un manque de données d’exposition et de risque en France, notamment pour les substances chimiques présentes dans l’environnement général. Ces données sont pourtant nécessaires pour pouvoir surveiller les expositions de la population et mener des évaluations de risque basées sur l’exposition réelle de la population.
Période de latence
Le choix d’une période de latence de 10 ans entre la prévalence d’exposition au facteur de risque et le risque de cancer est relativement arbitraire et peut surestimer ou sous-estimer les résultats. La durée réelle de cette latence dépend en effet des mécanismes biologiques de cancérogénèse et de l’exposition à d’autres facteurs de risque, et n’est en général pas connue précisément, d’où notre hypothèse de 10 ans pour la majorité des facteurs de risque, à moins que des études existantes aient montré une durée différente (plus longue pour les expositions professionnelles, plus courte pour les traitements hormonaux, par exemple).
Données d’exposition
Par ailleurs, pour la plupart des facteurs de risque, la mesure de l’exposition était transversale, les mesures de l’exposition tout au long de la vie et les RR correspondant à ces expositions n’étant pas disponibles. Des données d’exposition au cours du temps et par âge ont été prises en compte dans quelques cas, comme pour les radiations ionisantes, le modèle de risque correspondant étant basé sur la dose d’exposition cumulée et sur l’âge à l’exposition.
Qualité et cohérence des données utilisées
La qualité et la précision de l’estimation des FA dépendent fortement de la qualité des données d’exposition, des estimations de risque et des données d’incidence. Malgré les efforts accomplis pour recueillir les données de la meilleure qualité, leur disponibilité était variable et hétérogène selon les facteurs de risque.
L’estimation des expositions et celle des risques étant basées sur des études distinctes, l’hypothèse sous-jacente au calcul de la FA est que la population française était exposée de façon similaire à celle de la population de l’étude utilisée pour l’estimation du risque.
La plupart des estimations de risque utilisées étaient basées sur des études de cohortes ou des méta-analyses d’études de cohortes, fournissant des risques relatifs (RR), mais parfois aussi sur des études cas-témoin fournissant des odds-ratio (OR). Dans ce cas, l’OR a été considéré comme une approximation du RR, ce qui peut conduire à une légère surestimation des RR et donc du nombre de cas de cancers attribuables estimés 15. De telles hypothèses existent également lorsque les risques extraits des études ne sont pas détaillés par âge.
Hypothèse d’indépendance
Enfin, la formule utilisée pour estimer la FA par localisation (formule 3) suppose l’indépendance et l’absence d’interaction entre les facteurs de risque individuels. Or, on sait que certains facteurs de risque étudiés ne sont pas indépendants (alcool et tabac, par exemple) ; utiliser cette formule pour obtenir une FA par localisation peut mener à des surestimations ou des sous-estimations des FA.
Combinaison des résultats
L’estimation du nombre total de cancers attribuables aux facteurs de risque liés au mode de vie et à l’environnement conduit à comparer et hiérarchiser leurs impacts dans la survenue de nouveaux cas de cancer en France (voir l’article suivant 8). Elle représente donc un outil précieux, basé sur des données scientifiques fiables, crucial pour informer à la fois la population et les décideurs des facteurs sur lesquels ils peuvent agir pour réduire le risque de cancer et mettre en place des politiques de prévention ciblées. Une attention particulière a été portée à l’homogénéité de la méthode d’estimation de la FA utilisée pour chaque facteur de risque, afin de rendre les estimations comparables. Néanmoins, des ajustements méthodologiques ont été nécessaires pour l’analyse de certains facteurs de risque, afin de tenir compte des spécificités des données d’exposition et des estimations de risque disponibles. Ceci a permis de produire les meilleures estimations de la FA à chaque facteur de risque, mais apporte inévitablement de l’hétérogénéité entre les différentes estimations, notamment dans l’ordre de grandeur de leurs incertitudes, ce qui en fragilise la combinaison et la comparaison. Les incertitudes liées à l’estimation de la FA pour chaque facteur de risque sont détaillées dans les chapitres du rapport complet de l’étude et dans les publications internationales correspondantes 7.
D’un point de vue organisationnel, les membres des groupes de travail, spécialistes de chaque facteur de risque étudié, ont été fortement impliqués dans les choix méthodologiques et la revue critique des résultats, ce qui a permis d’assurer la pertinence et la qualité de la méthodologie et des données utilisées pour le contexte français. L’implication de plus de 80 collaborateurs des principales institutions de recherche et de santé publique françaises permet d’assurer un consensus sur les résultats fournis.
Un rapport global présente la méthodologie et les résultats détaillés par facteur de risque (données d’exposition et de risque utilisées, formule appliquée, hypothèses et limites spécifiques à l’étude de chaque facteur) ; il est disponible sur le site Internet du Circ 7. La méthodologie et les résultats de l’analyse détaillés pour chaque facteur de risque ont aussi été publiés indépendamment dans des revues scientifiques internationales 16,17,18,19,20,21,22,23,24,25,26,27. L’article qui suit dans ce numéro du BEH 8 présente le résultat global de l’étude, c’est-à-dire l’estimation de la FA à chaque facteur de risque et à l’ensemble des facteurs de risque combinés, toutes localisations de cancer confondues.
Remerciements
Nous remercions l’Institut national du cancer, financeur du projet. Nous remercions l’ensemble des collaborateurs, et particulièrement Alain Monnereau (réseau Francim), Zoé Uhry (Santé publique France et Hospices civils de Lyon) et Florence de Maria (Santé publique France), pour leur aide précieuse pour l’acquisition de données d’incidence des cancers.




