Signalement de cas groupés de syndromes de choc toxique staphylococcique d’origine menstruelle, Pays de la Loire, 2013 et 2016
// Reporting of clusters of staphylococcal toxic shock syndrome linked to menstruation, Pays de la Loire (France), 2013 and 2016
Résumé
Contexte –
Des cas de syndromes de choc toxique staphylococcique (CTS) liés à l’utilisation de tampons périodiques ont été signalés à deux reprises en Pays de la Loire, en raison de leur survenue rapprochée dans le temps : 2 cas en 2013 et 3 cas en 2016, dont des sœurs jumelles. Il s’agit d’une affection rare (environ 20 cas décrits en France par an par le Centre national de référence (CNR) des Staphylocoques), causée par une souche de Staphylococcus aureus productrice de toxine TSST-1. Des investigations épidémiologiques et microbiologiques ont été menées pour décrire ces deux épisodes de cas groupés.
Méthodes –
Les cas étaient définis selon les critères cliniques et biologiques des Centers for Disease Control and Prevention (États-Unis). Un questionnaire a été complété pour chaque cas afin de décrire les caractéristiques cliniques, biologiques et l’utilisation de tampons par les jeunes filles. Un risque individuel de récidive, caractérisé par l’absence d’anticorps sériques dirigés contre la toxine TSST-1, a été évalué par le CNR des Staphylocoques.
Résultats –
Parmi les 5 cas de CTS, 3 étaient certains et 2 autres probables mais confirmés par la bactériologie. Une mauvaise utilisation des tampons a été décrite : le tampon était porté la nuit (soit une durée d’utilisation supérieure à huit heures) par 4 cas et utilisé avant la date attendue des règles pour un cas. L’ensemble des cas présentait un risque accru de récidive impliquant d’éviter l’utilisation de tampons vaginaux.
Discussion –
Le risque de développer un CTS d’origine menstruelle est le plus souvent associé au mésusage des tampons périodiques. Il est important d’évaluer le risque de récidive chez ces jeunes filles par la recherche d’anticorps protecteurs contre la toxine.
Abstract
Background –
Some cases of staphylococcal toxic shock syndromes linked to the use of periodic tampons were reported on two occasions in the Pays de la Loire, due to the occurence close in time: 2 cases in 2013 and 3 cases in 2016, including twin sisters. This is a rare condition (about 20 cases described per year in France by the National Reference Centre (CNR Staphylocoques) caused by a strain of TSST-1 toxin-producing Staphylococcus aureus. Epidemiological and microbiological investigations were conducted to describe reported cases, in both episodes, according to their clinical signs, biological results and risk factors.
Methods –
Cases were defined according to the clinical and biological criteria of the Centers for Disease Control and Prevention (USA). A questionnaire was completed for each case to describe the clinical, biological characteristics, and the use of tampons by girls. An individual risk of recurrence, characterized by the absence of serum antibodies to the TSST-1 toxin, was assessed by the CNR Staphylocoques.
Results –
Among the 5 cases of STSS, 3 cases were certain and 2 others probable but confirmed by bacteriology. A bad use of the tampons was described: tampon was worn at night (a duration of use greater than 8 hours) by 4 cases and used before the expected date of the menstruations for one case. All cases had an increased risk of recurrence and has to avoid using vagina tampons.
Discussion –
The risk of developing a menstrual TSS is most often associated with the misuse of tampons. It is important to estimate the risk of recurrence in these girls by looking for protective antibodies against the toxin.
Introduction
Le syndrome de choc toxique staphylococcique (CTS) est une affection rare potentiellement sévère, causée par une souche de Staphylococcus aureus productrice de la toxine du choc toxique staphylococcique (TSST-1). Cette toxine est un superantigène provoquant une cascade inflammatoire systémique, favorisée par l’absence ou une quantité insuffisante d’anticorps anti-TSST-1 1.
Le CTS d’origine menstruelle (CTS-M) a été décrit pour la première fois en 1978 par Todd et coll. 2. Une augmentation très importante du nombre de cas de CTS, principalement chez des jeunes femmes, a été identifiée en 1980 aux États-Unis, mettant en évidence un lien entre le CTS-M et le port d’un tampon périodique 3,4. Une marque, RELY®, avait alors été mise en cause ; elle commercialisait des tampons occlusifs et hyperabsorbants. Les études menées à l’époque ont conduit à la mise en œuvre de recommandations/réglementations sur la fabrication des tampons (pouvoir absorbant, composition…), diminuant ainsi l’incidence des CTS. Aux États-Unis, la déclaration des CTS est devenue obligatoire en 1980.
En France, la surveillance des CTS est assurée par le Centre national de référence (CNR) des Staphylocoques à Lyon, qui recueille des données sur les cas et analyse les souches de staphylocoque transmises par des cliniciens ou des biologistes à des fins diagnostiques et épidémiologiques. Le CNR recense en moyenne une vingtaine de cas de CTS-M par an. Les quatre facteurs requis pour le développement de CTS-M semblent être : une colonisation vaginale par une souche de S. aureus toxinogène, la production de TSST-1, la pénétration à travers l’épithélium vaginal d’une quantité suffisante de TSST-1 pour causer la pathologie et l’absence ou le titre insuffisant d’anticorps neutralisants cette toxine 1.
Maladie peu connue du grand public, elle fait l’objet d’une couverture médiatique importante depuis quelques années. Le CNR et Santé publique France ont rappelé, par une mise au point publiée en mai 2017, que les données recueillies ne mettaient pas en évidence d’augmentation significative du nombre de cas rapportés de CTS-M au cours des six dernières années mais qu’il fallait maintenir une surveillance 5.
Signalement
En Pays de la Loire, l’Agence régionale de santé (ARS) a été alertée à deux reprises de plusieurs cas de CTS-M chez des jeunes filles, dont la survenue était rapprochée dans le temps : 2 cas en 2013 et 3 cas en 2016, dont des sœurs jumelles. Ces signalements avaient été effectués spontanément par les cliniciens ayant pris en charge les patientes, s’inquiétant de la concomitance de la survenue de ces cas. La Cellule d’intervention en région (Cire) Pays de la Loire de Santé publique France a été saisie par l’ARS pour une aide à la caractérisation du signal et à l’investigation.
L’objet de cet article est de décrire les cas signalés lors de ces deux épisodes en termes de signes cliniques, de résultats bactériologiques et de facteurs de risque.
Méthodes
Investigation épidémiologique
La démarche d’investigation retenue par la Cire, en lien avec l’ARS des Pays de la Loire et le CNR Staphylocoque pour les deux épisodes, a été de :
–décrire précisément le mode d’utilisation des tampons vaginaux par les 5 cas et la chronologie de survenue du CTS par rapport à la période menstruelle ;
–s’assurer que les mesures de gestion individuelles étaient bien initiées, notamment l’évaluation du risque individuel de récidive ;
–confirmer l’absence d’autres cas similaires diagnostiqués dans la région sur une même période.
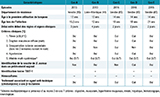
Nous avons utilisé la définition d’un syndrome de choc toxique des Centers for Disease Control and Prevention (CDC, États-Unis) regroupant plusieurs critères biologiques associés à des critères cliniques (listés dans le tableau 1). La présence des cinq critères cliniques permet de définir un cas certain et celle de quatre d’entre eux un cas probable 6.
 Agrandir l'image
Agrandir l'imageUn cas confirmé par la bactériologie était caractérisé par l’isolement de la souche de S. aureus producteur de la TSST-1.
Un cas de CTS d’origine menstruelle était défini par la survenue des symptômes pendant la période de menstruation ou jusqu’à trois jours suivant la fin des règles.
Lors de chaque investigation, en 2013 et en 2016, un questionnaire exploratoire standardisé a été complété pour chaque cas par téléphone auprès des cliniciens, des cas et de leur famille. Il recueillait les caractéristiques démographiques, cliniques et biologiques et des informations sur l’utilisation des tampons. Les données de la fiche de recueil des données médicales en cas de suspicion de choc toxique staphylococcique du CNR, qui accompagnait chaque prélèvement à analyser, ont été consultées.
Chaque entretien avec des cas était précédé, pour les mineures, d’une information donnée aux parents par téléphone par un médecin de l’ARS, et suivi par des recommandations d’utilisation des tampons.
Investigation microbiologique
Des examens bactériologiques ont été réalisés sur des hémocultures et des prélèvements vaginaux. Un génotypage a été réalisé sur les souches de S. aureus isolées pour rechercher des gènes producteurs de toxines.
Un risque individuel de récidive est associé à l’absence d’anticorps sériques dirigés contre la toxine TSST-1. Un dosage initial des anticorps anti-TSST-1 a été réalisé par le CNR pour chaque cas. Une séroconversion a été recherchée par un 2e prélèvement réalisé trois semaines plus tard.
Recherche active de cas
Une recherche active (par téléphone et courriel) d’autres cas de CTS-M en région Pays de la Loire a été effectuée, aux moments des signalements (2013, 2016), auprès des services de réanimation adulte et pédiatrique de la région, du Centre antipoison et du CNR des Staphylocoques.
Cette recherche de cas a été complétée par une analyse régionale des données des résumés de passages aux urgences. Le code de la CIM-10 (Classification internationale des maladies – 10e révision) utilisé était A483, correspondant à un syndrome de choc toxique.
Résultats
Investigation épidémiologique
Description clinique des 5 cas
Parmi les 5 cas de CTS, 3 cas présentant l’ensemble des cinq critères cliniques ont été classés comme certains. Les 2 autres étaient probables : une desquamation cutanée secondaire au rash n’a pas été observée ; cependant, les quatre autres critères cliniques étaient présents. L’évolution a été favorable pour tous les cas.
Le tableau 2 présente une synthèse des caractéristiques des 5 jeunes filles. Elles étaient âgées de 12 à 21 ans et toutes ont été hospitalisées en réanimation. Au début de la maladie, les cas présentaient un tableau fébrile sans autre signe spécifique. Aucun antécédent médical gynécologique n’a été décrit pour les 5 cas. Cependant, le cas D a rapporté des épisodes antérieurs et répétés de fatigue et de vertiges survenus pendant ses règles avec l’utilisation de tampons.
Un lien entre la survenue du CTS et le port de tampons périodiques a été proposé par les cliniciens en l’absence d’autres portes d’entrée décrites (notamment des lésions cutanées). Le délai médian entre le début des règles et la survenue des premiers signes cliniques était de 2 jours (étendue 2-4 jours).
 Agrandir l'image
Agrandir l'imageRecherche de facteurs de risque (tableau 3)
Au moment de l’infection, l’antériorité d’utilisation de tampons variait de un an à sept ans.
Les jeunes filles ont jugé que les niveaux d’absorption des tampons utilisés étaient en adéquation avec leur flux menstruel. Pour 4 cas, un tampon était porté la nuit, soit une durée d’utilisation en continu supérieure à 8 heures. Pour 1 cas, il avait été mis en place la nuit précédant la date attendue des règles. Aucun mésusage du tampon n’a été décrit pour le cas E.
Le lavage des mains avant et après la mise en place du tampon était variable selon les cas.
Les jeunes filles utilisaient des marques différentes de tampons, avec des types (avec ou sans applicateur) et des pouvoirs absorbants différents. Trois cas (A, C et D) utilisaient des tampons d’absorption super/super+. Le même niveau d’absorption était utilisé tout au long du cycle menstruel chez les cas A et B.
 Agrandir l'image
Agrandir l'imageRecherche de lien commun entre les cas
En 2013, les deux cas résidaient et fréquentaient des établissements scolaires dans deux départements différents, sans lien identifié.
En 2016, deux cas étaient des sœurs jumelles (C et D), leur commune de résidence était différente de celle du 3e cas signalé, distantes entres elles de 50 km.
Investigation microbiologique
La mise en culture des prélèvements vaginaux des cas B, D et E, tous réalisés après une antibiothérapie, a permis d’identifier une souche de S. aureus. Les analyses du CNR ont conclu à une souche appartenant au complexe clonal CC30, agr3, produisant la toxine TSST-1 et l’entérotoxine A.
Le prélèvement vaginal du cas A a été mis en culture pendant 4 jours sans résultat. Concernant le cas C, la culture du prélèvement vaginal retrouvait une flore polymorphe normale. Aucune analyse bactériologique des tampons des jeunes filles n’a été réalisée.
Évaluation de la récidive
Toutes les jeunes filles étaient séronégatives pour les anticorps anti-TSST-1 au moment du choc toxique. Aucune séroconversion n’a été mis en évidence sur les sérums prélevés 3 semaines après le premier prélèvement.
Recherche active d’autres cas
Aucun autre cas récent n’a été identifié par d’autres sources de données pour les deux épisodes.
Discussion
Le signalement spontané des cliniciens reposait sur la survenue de cas de CST-M regroupés dans le temps pour chacun des deux épisodes décrits en 2013 et 2016. Les données cliniques, épidémiologiques et microbiologiques recueillies chez ces jeunes filles étaient en faveur de cas de choc toxique staphylococcique d’origine menstruelle, sans lien décrit entre elles, et attribués à une mauvaise utilisation de tampons vaginaux dans chacun des épisodes.
Alors que l’utilisation des tampons est fréquente chez les femmes, l’incidence de la maladie reste faible. La majorité des femmes sont principalement colonisées par des souches de S. aureus non toxinogènes et présentent des anticorps anti-TSST-1 persistants 1. Une étude de séroprévalence, conduite aux États-Unis, a montré que 81% des adolescentes de 13 à 18 ans avaient développé des anticorps anti-TSST-1 1. Une autre étude, également menée aux États-Unis, a montré un taux d’incidence annuel du CTS-M de 1,4 cas pour 100 000 femmes âgées de 13 à 24 ans 7.
Concernant les signes cliniques, trois cas ont présenté la totalité des cinq signes cliniques définissant un CTS. L’absence de desquamation cutanée secondaire observée pour deux cas était en cohérence avec d’autres études décrivant ce signe comme inconstant, avec une fréquence décrite proche de 40% 6.
Les examens microbiologiques (culture du prélèvement vaginal et identification du gène producteur de TSST-1) ont permis de confirmer les deux cas probables. Ils doivent être considérés comme un élément de diagnostic complémentaire. Le clone identifié est celui qui prédomine classiquement en France et est responsable de choc menstruel. Une identification du clone a été possible, bien que les prélèvements aient été réalisés après la mise sous antibiotique.
Le mécanisme d’action joué par le tampon est encore mal connu et un cas associé à l’utilisation d’une coupe menstruelle a été rapporté dans la littérature 8. Des travaux ont mis en évidence le rôle de la composition de la flore vaginale, qui faciliterait la survenue d’un CTS en augmentant la production de TSST-1 9, ce qui pourrait expliquer la survenue chez des sœurs jumelles. Un projet d’étude est en cours au CNR pour étudier l’impact du microbiote vaginal dans le développement du CTS-M. Ce projet pourrait dans le futur permettre le développement de nouvelles techniques de prévention chez les personnes à risque de CTS-M 5.
L’investigation menée auprès des jeunes filles a mis en évidence une mauvaise utilisation de ces tampons. Il apparait que le risque de développer un CTS-M est lié au mésusage des tampons périodiques. Il est proportionnel à l’absorbance du tampon utilisé, à la durée d’utilisation du tampon, au nombre de tampons utilisés durant les menstruations et au nombre de jours d’utilisation de tampons 10. Ainsi, les recommandations présentes sur les notices d’utilisation des tampons doivent être respectées : les tampons ne doivent être utilisés qu’en période menstruelle et changés régulièrement. L’absorbance des tampons devra être adaptée au flux des menstruations (voir encadré 1). Il est également important de rappeler les règles d’hygiène de base, notamment en matière de lavage des mains avant la mise en place et le changement de tampon.
Recommandations aux jeunes filles pour prévenir le choc toxique staphylococcique menstruel (CTS) [12]
Les jeunes filles et les femmes qui utilisent des tampons ou des coupes menstruelles peuvent prévenir le CTS et réduire les risques liés à leur utilisation en suivant les recommandations suivantes :
• lisez la notice qui accompagne les tampons et suivez toutes les instructions ;
• évitez d’utiliser des tampons si vous avez déjà reçu un diagnostic de CTS ;
• lavez-vous les mains au savon avant d’insérer ou de retirer un tampon, une coupe menstruelle ;
• changez de tampon toutes les 4 à 8 heures et évitez d’en porter la nuit : n’utilisez un tampon que pendant une partie de la journée en alternant l’utilisation des tampons et des serviettes hygiéniques. Utilisez, par exemple, des serviettes la nuit et des tampons le jour ;
• n’oubliez pas d’enlever le tampon ;
• attendez le début de vos règles avant d’utiliser un tampon. Évitez d’utiliser un tampon par mesure de précaution lorsque vous vous attendez à être menstruée d’une journée à l’autre ou pour absorber d’autres types de pertes ;
• utilisez des tampons ayant un pouvoir absorbant minimal nécessaire pour répondre à vos besoins personnels. Le risque de contracter un CTS est plus élevé avec des tampons très absorbants.
Afin d’évaluer le risque de récidive des cas et orienter les recommandations aux jeunes filles, les anticorps sériques dirigés contre la TSST-1 ont été recherchés par une technique développée par le CNR des Staphylocoques depuis 2010 11 : réalisation d’une sérologie précoce, suivie par une sérologie plus tardive 3 à 4 semaines plus tard. La persistance de l’absence d’anticorps, retrouvée pour les 5 cas, est donc indicatrice d’un risque accru de récidive impliquant d’éviter l’utilisation de tampons vaginaux par ces jeunes filles 12.
Le choc toxique staphylococcique menstruel est rare mais nécessite un diagnostic et une prise en charge rapide. Il doit être évoqué chez des femmes jeunes, sans antécédents particuliers, présentant un syndrome de choc en période menstruelle, et notamment en cas d’utilisation de tampons ou de coupes menstruelles. Suite à ces signalements, des recommandations ont été transmises aux services de réanimation de la région, encourageant le signalement des cas au CNR pour une aide au diagnostic et au suivi de la prise en charge (voir encadré 2).
Choc toxique staphylococcique menstruel (CTS) : recommandations aux cliniciens
En cas de suspicion de CTS d’origine menstruelle (à envisager chez des adolescentes présentant un syndrome de choc associé à des menstruations récentes et à une utilisation de tampons) :
• retirer rapidement le tampon hygiénique et l’envoyer au laboratoire pour analyses bactériologiques ;
• confirmer l’étiologie et mettre en évidence une souche de staphylocoque par :
– une analyse bactériologique du tampon lui-même ;
– un prélèvement vaginal réalisé de façon précoce et si possible avant la mise sous antibiotique ;
• si une souche est identifiée, la transmettre au CNR pour rechercher la toxine ;
• évaluer le risque de récidive par une recherche d’anticorps sériques dirigés contre la TSST-1 (analyse CNR). La persistance de l’absence d’anticorps est associée à un risque accru de récidive impliquant d’éviter l’utilisation de tampons vaginaux [12].
Références
79(6):1835-42.




