Entérocoques résistants aux glycopeptides dans les établissements de santé en France : données épidémiologiques du signalement des infections nosocomiales, juillet 2001 - juin 2015
// Glycopeptides-resistant Enterococci in healthcare facilities in France: Epidemiological data from the healthcare-associated infection early warning and response system, July 2001 - June 2015
Résumé
Les entérocoques résistants aux glycopeptides (ERG) sont des entérocoques ayant développé une résistance non naturelle à au moins un antibiotique de la famille des glycopeptides. Par ailleurs, Enteroccocus faecium fait partie des bactéries hautement résistantes émergentes (BHRe). Selon les données du réseau européen de surveillance de la résistance bactérienne aux antibiotiques (EARS-Net), la proportion d’ERG a augmenté significativement en Europe depuis 2002, mais elle reste stable et inférieure à 2% en France depuis 2007 (0,5% en 2014). L’objectif de cette étude était de décrire l’évolution des signalements d’infection/colonisation à ERG reçus via le dispositif de signalement externe des infections nosocomiales (SIN) de juillet 2001 à juin 2015.
Les caractéristiques de ces SIN (services déclarants, infections/colonisations, mesures de contrôles) ont été analysées. Sur la période de l’étude, 17 743 SIN ont été transmis, dont 1 440 (8,1%) impliquaient des ERG correspondant à près de 3 000 patients dans 486 établissements. La majorité des SIN impliquant des ERG (84%) rapportaient une colonisation, 8% une infection et 3% les deux. Trois régions ont émis plus de la moitié des SIN d’ERG, surtout entre 2007 et 2010 : Île-de-France (30%), Lorraine (18%) et Nord-Pas-de-Calais (10%). Pour 29% des épisodes signalés, il s’agissait de cas groupés, avec une médiane de 3 cas par épisode. Enterococcus faecium était impliqué dans 95% des SIN et le mécanisme de résistance de type VanA était le plus fréquemment retrouvé (72%). Plus de 70% des établissements menaient des investigations locales et avaient pris des mesures de gestion à la date du signalement. La description d’une épidémie dans l’interrégion Sud-Ouest illustre ces modalités d’investigation et de prévention. Le nombre de SIN d’ERG a nettement augmenté entre 2003 (5 SIN, soit 0,7% du total des SIN) et 2008 (245 SIN, soit 18,6%), période marquée par des épidémies importantes dans le nord et l’est de la France. Ce chiffre a diminué en 2009 et s’est stabilisé entre 110 et 155 SIN reçus (environ 8%) jusqu’en 2014. Depuis, la proportion de SIN d’ERG semble augmenter, avec 114 SIN (9,9%) reçus pour les six premiers mois de 2015.
Abstract
Glycopeptides resistant enterococci (GRE) are bacteria with a non-natural resistance to at least one antibiotic from the glycopeptide family. Moreover, Enteroccocus faecium belongs to highly resistant emergent bacteria. According to data from European Antimicrobial Resistance Surveillance Network (EARS-Net), the proportion of GRE has increased significantly in Europe since 2002, but remains stable and below 2% in France since 2007 (0.5% in 2014). The purpose of this study is to describe trends in notifications of GRE infection/colonization received through the mandatory healthcare-associated infection (HAI) early warning and response system (Signalement des infections nosocomiales) between July 2001 and June 2015.
The characteristics of notified events and control measures were analyzed. Over the study period, 17,743 HAI events were notified, of which 1,440 (8.1%) involved GRE, totaling about 3,000 patients from 486 different institutions. Most of these notifications (84%) reported one or more colonization(s), 8% one infection, and 3% both. Three regions issued more than half of GRE notifications, especially between 2007 and 2010: Ile-de-France (30%), Lorraine (18%), and Nord-Pas-de-Calais (10%). Clusters were reported in 29% of GRE notifications, with a median of 3 cases per cluster. Enterococcus faecium was the most frequently reported pathogen (95% of notifications) and VanA the most frequently found resistance mechanism (72%). Local investigations and control measures were reported in 70% of GRE notifications. An outbreak in Southwestern France is described to illustrate such measures. The yearly number of GRE notifications increased significantly from 2003 (n=5, representing 0.7% of all HAI notifications) to 2008 (n=245, 18.6%), when important outbreaks were reported in Northern and Eastern France. This number declined and remained stable from 2009 to 2014 (n=110 to 155, about 8%), and increased again with 114 notifications (9.9%) for the first 6 months of 2015.
Introduction
Les entérocoques sont des bactéries à Gram positif, anaérobies facultatives commensales du tube digestif de l’Homme et de nombreux animaux. Une vingtaine d’espèces d’entérocoques a été décrite, mais plus de 95% des infections à entérocoques sont causées par seulement deux espèces : Enterococcus faecalis (80-90%) et Enterococcus faecium (5-10%) 1. Les entérocoques sont naturellement résistants à de nombreux antibiotiques comme les céphalosporines, les aminosides de bas niveau, la clindamycine, les fluoroquinolones, le cotrimoxazole. Les entérocoques résistants aux glycopeptides (ERG), parfois aussi appelés entérocoques résistants à la vancomycine (ERV), sont des entérocoques ayant développé une résistance non naturelle à au moins un des antibiotiques de la famille des glycopeptides : la vancomycine et la teicoplanine. Les premières souches d’ERG ont été isolées en 1987-1988 en France et au Royaume-Uni, avant de devenir endémiques aux États-Unis à la fin des années 1990 ; leur émergence en France remonte à 2004, lorsque les premières épidémies ont été rapportées dans plusieurs hôpitaux français 2. La transmission des entérocoques se fait par les mains 3, le matériel ou l’environnement contaminé 4 ; elle est facilitée par la diarrhée ou l’incontinence fécale. En milieu hospitalier, la transmission d’ERG est essentiellement manuportée depuis un patient porteur. Les ERG peuvent persister dans les selles pendant plusieurs semaines, parfois des mois 5. Les personnes porteuses peuvent donc l’être encore au moment d’une nouvelle admission à l’hôpital.
En France, la proportion de résistance à la vancomycine chez les entérocoques isolés en milieu hospitalier est stable depuis plusieurs année et estimée à moins de 2% depuis 2007, bien que des épidémies aient été régulièrement signalées 2. En 2012, les entérocoques représentaient 6,9% des microorganismes isolés lors d’infections nosocomiales en établissements de santé et se situaient au 4e rang après Escherichia coli, Staphylococcus aureus et Pseudomonas aeruginosa 6. L’espèce la plus fréquemment concernée par la résistance est Enterococcus faecium. La résistance aux glycopeptides peut être due à six gènes acquis par les entérocoques: vanA, vanB, vanD, vanE, vanG, vanL. Les mécanismes les plus souvent rapportés en Europe sont liés aux gènes vanA et vanB. La souche clinique la plus fréquemment isolée en Europe est E. faecium résistant de type vanA 7.
L’objectif de cette étude était de réaliser un bilan de l’épidémiologie des infections à ERG dans les établissements de santé français, à partir des données issues du dispositif du SIN (signalement externe des infections nosocomiales) reçues à l’Institut de veille sanitaire (InVS) (1) entre le 26 juillet 2001 et le 30 juin 2015.
Méthodes
Les infections nosocomiales sont définies comme des infections survenant au cours ou au décours d’une hospitalisation. Mis en place en juillet 2001, le SIN est un dispositif d’alerte réglementaire qui concerne tout établissement de santé, public ou privé (articles R6111-12 et suivants du Code de la Santé publique, http://www.legifrance.gouv.fr). Il a pour objectif la détection de situations à risque suffisamment graves, inhabituelles ou récurrentes pour nécessiter la mise en œuvre rapide de mesures de contrôle à l’échelon local, régional ou national. Les signalements sont adressés par les établissements de santé au Centre de coordination de la lutte contre les infections nosocomiales (CClin) et à l’Agence régionale de santé (ARS) dont ils relèvent, cette dernière les transmettant à l’InVS. Ce dispositif est dématérialisé via une application Web (e-SIN) depuis le 1er janvier 2012.
Parmi les critères de signalement d’infections nosocomiales définis réglementairement 8 figurent notamment la nature, les caractéristiques ou le profil de résistance aux anti-infectieux de l’agent pathogène en cause (critère 1a) ; les colonisations doivent aussi faire l’objet d’un signalement si le phénotype de résistance aux antibiotiques est rare ou émergent. La survenue d’une colonisation ou d’une infection nosocomiale à ERG entre dans ce cadre, et les établissements de santé sont incités à les signaler depuis 2005.
Un SIN correspond à un événement et peut concerner plusieurs cas d’infection et/ou colonisation. La fiche de signalement précise le nom de l’établissement de santé, le(s) critère(s) de signalement utilisé(s), le nombre et le type des infections nosocomiales (site(s), microorganisme(s) et mécanisme de résistance, le(s) service(s) concerné(s). Tous ces indicateurs ont été analysés dans la présente étude.
Les mesures de contrôle instituées, la maîtrise de la situation et/ou le besoin d’une aide extérieure sont également précisés par les établissements de santé qui signalent, mais de manière souvent inégale, et n’ont donc pas pu faire l’objet d’une analyse détaillée.
Les signalements impliquant des ERG (E. faecium et/ou E. faecalis) tels que déclarés par les établissements de santé ont été identifiés par l’analyse rétrospective des signalements reçus entre le 26 juillet 2001 et le 30 juin 2015. Toutefois, du fait du caractère rétrospectif de l’étude, ces signalements n’étaient pas systématiquement confirmés par le Centre national de référence (CNR) des ERG ou un laboratoire expert. On parle de « cas groupé » lorsqu’au moins 2 cas d’infection ou colonisation à ERG sont rapportés dans un même signalement. Le lien épidémiologique entre les cas n’est cependant pas toujours confirmé. Des précisions liées aux services déclarants, aux événements infectieux et aux mesures de contrôles mise en place ont été décrites. Les analyses ont été réalisées sous Stata 12®.
Résultats
Nombre de SIN reçus
Sur les 17 743 SIN transmis à l’InVS entre le 26 juillet 2001 et le 30 juin 2015, 1 440 (8,1%) impliquaient des ERG correspondant à 2 968 patients (2). Ces derniers représentaient 3,8% des 77 473 patients infectés et/ou colonisés rapportés à la date du signalement. La proportion de SIN à ERG a nettement augmenté entre 2003 et 2008 (passant de 0,7% à 18,6%) ; la période 2007-2010 a en particulier été marquée par plusieurs épidémies régionales, notamment dans le nord-est du pays. Ce chiffre a diminué en 2009 et s’est stabilisé autour de 8% (entre 110 et 155 SIN) jusqu’en 2014. Depuis, la proportion de SIN semble augmenter : 9,9% (114 SIN) pour les six premiers mois de 2015 (figure 1). Au cours des premiers mois de l’année 2015, on note une certaine augmentation des SIN à ERG en comparaison avec l’année 2014, notamment en Île-de-France (19,2% de SIN ERG sur le nombre de SIN total), dans le Nord-Pas-de-Calais (6,6%), en Pays de la Loire (12,1%) et en Lorraine (8,7%).
 Agrandir l'image
Agrandir l'image
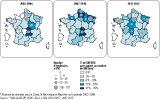
Les régions ayant signalé le plus grand nombre d’ERG sur la période de l’étude étaient l’Île-de-France (29,9% de l’ensemble des signalements impliquant des ERG), la Lorraine (17,9%), le Nord-Pas-de-Calais (10,2%), l’Alsace (7,9%) et Rhône-Alpes (6%). Sur la période de l’étude, ces SIN correspondaient respectivement à 10,8%, 25,8%, 9,4%, 13,9%, 5,2% des SIN reçus dans ces régions. Ce grand nombre de signalements est à mettre en parallèle avec plusieurs épidémies concomitantes ayant eu lieu dans ces régions. En effet, l’analyse descriptive des SIN permet d’identifier plusieurs contextes épidémiques dans certaines régions, notamment entre 2007 et 2010. De nombreux cas groupés ont été répertoriés : 27 en Île-de-France, 107 en Lorraine et 43 dans le Nord-Pas-de-Calais. La distribution géographique des SIN reçus depuis 2003 (figure 2) met particulièrement en exergue les cas groupés survenus entre 2007 et 2010 dans ces régions.
Sur l’ensemble des SIN, 428 (29%) concernaient des cas groupés principalement dus à la diffusion de souches d’E. faecium de type vanA. Une description détaillée de la gestion d’une épidémie d’ampleur inhabituelle, survenue dans le sud-ouest de la France entre 2013 et 2014, est rapportée dans l’encadré en fin d’article.
 Agrandir l'image
Agrandir l'image
Distribution des SIN à ERG selon le type d’établissement et de service
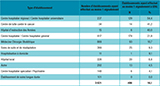
Les SIN à ERG ont été transmis par 486 établissements de santé (ES) différents, soit 16,1% des ES ayant procédé à un signalement (quel que soit son objet) pendant la période d’étude. Plus de la moitié (54%) des centres hospitaliers régionaux ou universitaires (CHR/CHU), 41% des centres de lutte contre le cancer (CLCC), 40% des hôpitaux d’instruction des armées (HIA) et 22% des centres hospitaliers (CH/-CHG) ont effectué au moins un SIN à ERG (tableau).
 Agrandir l'image
Agrandir l'image
Entre 2003 et 2006, 77 ES ont signalé une ou plusieurs infections ou colonisations à ERG. Ce chiffre a augmenté entre 2007 et 2010 avec 321 ES signaleurs ; de même entre 2011 et 2014, avec 327 ES signaleurs. Au cours des six premiers mois de 2015, 65 ES ont déjà signalé des ERG.
Pour 1 226 SIN (85,1%) impliquant des ERG, un seul type de service était cité ; pour 155 SIN (10,8%) deux types de services étaient cités et pour 59 SIN (4,1%) trois types de services. Étaient majoritairement concernés par ces SIN : la médecine (45,6% des SIN), et notamment les services de néphrologie, hématologie ou hépato-gastro-entérologie, la réanimation (19,4%), la chirurgie (15%) et les soins de suite et de réadaptation (SSR) (10,4%).
Caractéristiques des évènements infectieux signalés
Sur les 1 440 SIN à ERG, 1 372 (95,3%) n’impliquaient qu’un seul microorganisme, 48 (3,3%) en impliquaient deux et 20 (1,4%) en impliquaient trois. Les autres microorganismes les plus souvent retrouvés avec les ERG étaient Acinetobacter baumannii résistant à l’imipénème et Klebsiella pneumoniae résistante aux carbapénémases.
Sur les SIN pour lesquels les ERG étaient les seuls microorganismes impliqués, un seul site (colonisé ou infecté) était spécifié pour 1 261 SIN (92,5%), deux sites pour 89 SIN (6,5%) et trois sites pour 13 SIN (0,9 %). La variable permettant de définir la répartition des SIN selon le statut infecté ou colonisé des patients n’étant pas correctement renseignée avant 2012 (date d’implémentation de l’outil e-SIN), son analyse n’a porté que sur les 541 SIN reçus entre 2012 et 2015 : il s’agissait de colonisations pour 84% d’entre eux, d’infections pour 8% et, pour 3%, à la fois de colonisations et d’infections. Les 460 SIN rapportant un seul site anatomique notifiaient un site colonisé dans 87% des cas et un site infecté dans 13% des cas : il s’agissait principalement de colonisations digestives (97% des SIN avec site colonisé) et les infections étaient le plus souvent digestive (29%) ou urinaire (14%).
Les SIN à ERG rapportaient l’isolement d’E. faecium pour 1 334 d’entre eux et de E. faecalis pour 115 d’entre eux (9 SIN impliquaient ces deux microorganismes à la fois).
Le mécanisme de résistance était renseigné pour 231 (16%) des 1 440 signalements impliquant des ERG : de type vanA pour 167 (72%) d’entre eux, de type vanB pour 62 (27%) et de type vanD pour 2 d’entre eux (1%).
La souche de l'ERG isolé était envoyée au CNR ou à un laboratoire expert dans 34% des cas et ne l’était pas dans 41% des cas. La donnée était manquante pour 25% des SIN.
Le nombre de cas par SIN à ERG, à la date du signalement, variait de 1 à 55, et 29% (N=428) des épisodes signalés correspondaient à des cas groupés dont la médiane, de 3 cas par épisode (min=2, max=55), a diminué depuis 2004 (7 cas en 2004/2005 et 4 cas en 2015). Les cas groupés étaient dus à E. faecium dans 95% des cas et à E. faecalis dans 5% des cas. Ils étaient déclarés comme acquis dans l’établissement pour 571 SIN (40%), importés pour 597 (41%) et sans précision pour 272 (19%). Les cas isolés d’infection/colonisation à ERG semblent être en augmentation depuis 2013, tout comme les cas groupés, notamment les épisodes rapportant entre 2 et 5 cas.
Au total, 196 décès toutes causes confondues ont été rapportés dans les SIN impliquant au moins 1 ERG (sur un total de 4 324 décès rapportés à l’ensemble des SIN reçus). Sur les 1 372 SIN n’impliquant que des ERG (un seul microorganisme renseigné), 186 décès étaient rapportés pour 505 cas au total. Parmi ces 186 décès, 6 ont été rapportés comme liés à l’infection à ERG.
Le critère principalement (93%) évoqué pour justifier le SIN des infections à ERG était la rareté du microorganisme compte tenu de sa nature, de ses caractéristiques ou de son profil de résistance aux anti-infectieux, ce qui correspond au critère 1a.
Actions mises en place par les établissements
À la date du signalement de l’ERG, des investigations locales étaient réalisées ou en cours pour 79% des épisodes signalés (et 76% des cas groupés), des mesures correctives mises en place pour 72% d’entre eux (et 82% des cas groupés) et un besoin d’expertise extérieure mentionné dans 11% des SIN (et 14% des cas groupés). Enfin, le phénomène était considéré comme maîtrisé ou en cours de maîtrise pour 61% des épisodes signalés (et 44% des cas groupés).
Discussion
Au total, les 1 440 SIN à ERG représentent une part non négligeable (8,1%) de l’activité globale de signalement des établissements de santé et témoignent de leurs efforts en matière de détection et de contrôle suite aux multiples recommandations émises, notamment à partir de 2005. E. faecium reste, comme dans beaucoup de pays, l’espèce la plus souvent isolée parmi les ERG. Les cas groupés représentaient 29% des SIN à ERG reçus. Plus de la moitié des SIN à ERG étaient émis par trois régions, surtout entre 2007 et 2010 : l’Île-de-France (30%), la Lorraine (18%) et le Nord-Pas-de-Calais (10%) ; cette hétérogénéité s’explique notamment par la forte influence de certains phénomènes épidémiques sur le nombre de signalements effectués.
Cette étude a quelques limites, car elle repose sur l’analyse des caractéristiques des épisodes à la date de leur signalement et non sur leur description une fois les investigations conduites localement terminées. Il est donc probable que le total des cas rapportés soit sous-estimé. Par ailleurs, tous les cas signalés n’ont pas fait l’objet d’une confirmation par le CNR Résistance aux antibiotiques (http://www.cnr-resistance-antibiotiques.fr/). Cependant, les ERG sont d’un diagnostic facile dans tous les laboratoires des établissements de santé français. Enfin, certains établissements ont pu effectuer plusieurs SIN successifs pour un même épisode, ne précisant pas de lien épidémiologique entre eux. Ceci a pu conduire, lors de l’analyse des données, à une sous-estimation du nombre de cas groupés recensés.
Au cours des premiers mois de l’année 2015, on note une augmentation des SIN à ERG en comparaison avec l’année 2014, dans certaines régions : Île-de-France, Nord-Pas-de-Calais, Pays de la Loire et Lorraine. Même s’il convient de rester prudent dans l’analyse de ces tendances, il est possible que la situation dans ces régions puisse être influencée par l’épidémiologie des pays frontaliers du nord de la France, notamment les zones proches de l’Allemagne, où la proportion de résistance des entérocoques aux glycopeptides est en augmentation depuis plusieurs années et parmi les plus élevées en Europe (14,6% en 2013, 9,1% en 2014). Une étude allemande a montré qu’il existe un gradient s’étendant de l’est de l’Europe vers l’ouest avec les plus importantes proportions de résistance sur le territoire allemand 9. Seuls quelques pays (dont le Portugal et le Royaume-Uni) avaient de plus fortes proportions de résistance, allant de 10,1% à 45,1% de résistance selon les données 2014 de surveillance du réseau European Antimicrobial Resistance Surveillance System (EARS-Net) (3).
Concernant les données annuelles de résistance d’E. faecium à la vancomycine en France, issues du réseau EARS-Net France, il n’a pas été noté d’augmentation significative de la prévalence des ERG depuis 2001 (moins de 1% en 2014). Cependant, la surveillance européenne s’effectue uniquement sur la base de prélèvements invasifs alors que les entérocoques sont plus souvent responsables de colonisations et non d’infections. Les données de l’Enquête nationale de prévalence des infections nosocomiales en établissements de santé (ENP-2012) montrent des résultats similaires, avec une diminution de moitié des pourcentages de résistance aux glycopeptides pour E. faecium (8,6% en 2006 vs 4,4% en 2011) et de trois quarts pour E. faecalis (2,3% en 2006 vs 0,6% en 2012) 6.
Malgré une tendance récente à l’augmentation des SIN, qui reste à confirmer, la France était en 2014 le 6e pays (sur 29 participants) avec la plus faible proportion de résistance d’E. faecium à la vancomycine. Globalement, en Europe, la proportion d’ERG a augmenté depuis 2002, passant notamment, sur la période 2011-2014, de 6,2% à 7,9%. Cette proportion a augmenté en particulier dans quelques pays (Royaume-Uni, Danemark, Irlande ou Italie), mais est restée globalement stable en France depuis 2001, autour de 1%, en dehors d’un pic transitoire à 5% en 2004. Ce pic était lié à des épidémies dans les établissements participant au réseau et reflétait alors l’émergence en cours dans le nord et l’est de la France. Cette émergence a depuis été maîtrisée par les mesures de contrôles très strictes mises en place en France à cette période 10.
Ces mesures ont été mises à jour en 2013 par le Haut Conseil de la santé publique (HCSP) avec la publication de recommandations pour la maitrise des bactéries hautement résistance émergentes (BHRe) 11,12 ciblant notamment E. faecium résistant aux glycopeptides. Ces recommandations définissent les mesures de contrôle à mettre en œuvre dans les établissements de santé et établissements d’hébergement pour personnes âgées dépendantes (Ehpad) en cas de suspicion ou identification de patients porteurs d’ERG. Ces mesures sont appliquées par les équipes opérationnelles d’hygiène (EOH), avec le soutien des CClin. Dans le cadre d’un système d’alerte et de réponse précoce, le patient infecté ou porteur d’ERG doit être immédiatement signalé aux autorités sanitaires compétentes et être isolé en chambre individuelle, avec respect et mise en œuvre des précautions standards (hygiène des mains et gestion des excrétas) associées à des précautions complémentaires de type « contact » (PCC). De plus, un renforcement par des mesures de type BHRe est aussi recommandé : sectorisation des cas, des sujets contacts et des sujets non exposés ; personnels paramédicaux dédiés jours et nuits ou à défaut « marche en avant » ; limitation des transferts des cas ou à défaut information avant tout transfert de l’établissement d’aval. Un dépistage hebdomadaire des patients autour des cas doit aussi être organisé afin de circonscrire l’épidémie et au besoin d’adapter les mesures de contrôle. Les professionnels de santé peuvent être accompagnés sur le terrain par l’Antenne régionale de lutte contre les infections nosocomiales (Arlin) et le CClin. En parallèle, le Laboratoire Entérocoques associé au CNR Résistance aux antibiotiques peut apporter son expertise pour comparer plusieurs souches dans le cas d’épidémies prolongées ou impliquant plusieurs établissements.
La lutte contre la diffusion des ERG en France a été initiée en 2005 et a servi de modèle permettant ensuite de mettre en place des mesures de détection, prévention et contrôle similaires pour d’autres émergences, notamment Clostridium difficile 027 en 2006 puis les entérobactéries productrices de carbapénèmases (EPC, une autre BHRe) à partir de 2009. Si, grâce à ce modèle, la lutte contre les BHRe en France semble montrer des résultats encourageants (maintien des proportions de résistance des entérocoques aux glycopeptides et des Klebsiella pneumoniae aux carbapénèmes à moins de 1% selon les données du réseau EARS-Net), les mesures de contrôle des BHRe recommandées aux établissements de santé présentent certaines limites souvent rapportées : épuisement des professionnels de santé (surtout pour les épisodes de longue durée) et coût élevé des mesures de contrôle. Cependant, il a été montré que la mise en place des « mesures BHRe » permettait de réduire de façon importante le nombre de cas et la durée des épisodes 13 et que, dans le cadre d’un épisode régional, seul le cohorting avait permis de juguler l’épidémie 14. L’efficacité des mesures mises en place repose également sur une action et un dépistage rapides de tout patient suspecté d’être porteur avec, notamment : un dépistage systématique des patients ayant été hospitalisés à l’étranger dans l’année, un système d’information amélioré pour la gestion des cas ou patients contact en cas de réadmission et la promotion d’un meilleur usage des antibiotiques. En ce sens, le second axe du Propias (Programme national d’actions de prévention des infections associées aux soins), « Renforcer la prévention et la maitrise de l’antibiorésistance dans l’ensemble des secteurs de l’offre de soins » prévoit plusieurs objectifs annuels, notamment un taux d’ERV parmi les bactériémies à E. faecium ≤1%, une proportion de cas secondaires sur l’ensemble des cas de BHRe ≤20% et une proportion d’épisodes avec cas secondaires ≤10% 15.
La diffusion des ERG en France semble à ce jour avoir été contenue, notamment grâce à la reconnaissance précoce de leur émergence et aux mesures préconisées par le Comité technique des infections nosocomiales et des infections liées aux soins (CTINILS) 10 en 2005 puis par le HCSP 11,12 en 2013. Il convient toutefois de rester vigilant et de maintenir les efforts des EOH, en insistant notamment sur la nécessité du dépistage autour des premiers cas détectés et de la mise en œuvre de mesures complémentaires d’hygiène de type contact pour les patients porteurs.
Enfin, la problématique des BHRe évolue et il n’est plus rare aujourd’hui de découvrir un patient porteur d’ERG ou d’EPC, même si ces BHRe restent encore en phase d’émergence. Afin de ne pas surcharger le système de signalement, qui a une capacité globale limitée et doit rester un outil d’alerte et non de surveillance, il sera donc nécessaire de réexaminer la pertinence des critères actuels de signalement des ERG ou EPC. Ainsi, les efforts des EOH pourraient se concentrer sur le signalement et la gestion des cas groupés nécessitant un suivi par l’ARS et le réseau CClin/Arlin, ainsi que des cas sporadiques dans les régions les moins touchées où un accompagnement ciblé est nécessaire. En parallèle, une surveillance plus exhaustive et active de ces BHRe pourrait être maintenue, en lien avec les laboratoires et le CNR Résistance aux antibiotiques, via un outil dédié. Cette réflexion est en cours en 2016 en lien avec les acteurs concernés.
Références
Citer cet article
Épidémie départementale de colonisations à entérocoque résistant aux glycopeptides (ERG), France, septembre 2013 – avril 2014*
Historique
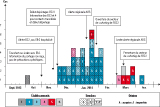
Le point de départ de cet épisode est l’identification d’un portage digestif d’ERG chez une patiente dans un établissement de santé (ES1) du Sud-Ouest. Les dépistages réalisés n’identifient pas localement de cas secondaire et la patiente est transférée vers un deuxième établissement (ES2). Suite à une défaillance dans l’information, l’équipe opérationnelle d’hygiène (EOH) de l’ES2 n’a connaissance de ce portage que trois semaines après son admission. Un dépistage des patients contacts encore hospitalisés identifie 2 cas secondaires. Suite à cette découverte, les dépistages sont étendus aux patients sortis (prélèvements en cas de ré-hospitalisation) et transférés dans d’autres établissements, identifiant d’autres patients porteurs d’ERG (figure). Cette épidémie a donné lieu à une alerte régionale par l’Agence régionale de santé (ARS), relayée aux régions limitrophes par le Centre de coordination de la lutte contre les infections nosocomiales (CClin).
Chiffres-clés
Épidémie la plus importante dans l’interrégion Sud-Ouest depuis l’émergence des ERG en France :
40 cas de colonisation à Enteroccocus faecium VanB, dont 23 dans l’établissement ES1 ;
3 clones identifiés par le Centre national de référence des entérocoques, dont 1 majoritaire ;
19 services concernés dans 6 établissements de santé différents ;
9 signalements externes d’infection nosocomiale via e-SIN ;
plus de 1 000 patients contacts identifiés, dont 60% avec au moins un dépistage ;
absence de cas identifié suite à l’alerte ARS en dehors du département ;
durée de l’épidémie : 5 mois.
Points-clés
EOH et CLIN, acteurs majeurs de la réussite de la gestion de cet épisode, avec un soutien fort des directions.
Importance de l’information inter-établissements lors du transfert de cas ou de patient contact dans les premiers temps de l’épidémie.
Performance des Départements d’information médicale (DIM) pour intégrer rapidement un système de suivi informatique différencié des cas et des contacts.
Mise en place d’un secteur de cohorting dès la survenue des premiers cas et nécessité de convaincre l’ensemble des acteurs de l’importance des mesures autour des patients non infectés.
Précautions standard perfectibles dans les services où la transmission croisée a été avérée.
Intérêt de la technique de PCR par le laboratoire permettant d’être plus réactif, notamment pour le prélèvement de dépistage avant sortie ou transfert des contacts.
Dynamique des secrétariats médicaux pour les différents courriers d’information aux patients et aux partenaires extérieurs.
Coût important des dépistages et quantité de travail associée à une augmentation des délais de gestion d’autres prélèvements à visée diagnostique.
Infirmier dédié assurant également le rôle d’aide-soignant dans un service ne pouvant dédier infirmier et aide-soignant pour un patient ERG.
Sortie de l’épidémie
Décision pour les contacts de poursuivre les dépistages lors d’une réadmission jusqu’à six mois après l’identification du dernier cas et, en l’absence de résultat positif, sortie de l’ensemble des contacts de la cohorte à cette date.
Décision, pour les cas, de prise en charge en précautions complémentaires contact pendant un an après l’identification du dernier cas ; si hospitalisation au-delà de l’année, réalisation d’un dépistage par PCR à l’admission, si résultat négatif : sortie de la cohorte cas.
 Agrandir l'image
Agrandir l'image
* Encadré rédigé par Caroline Bervas et Anne-Gaëlle Venier – CCLIN Sud-Ouest, Bordeaux, France




