Mortalité liée à la drépanocytose en France : âge de décès et causes associées (1979-2010)
// Sickle-cell related mortality in France: age and causes of death
Résumé
Introduction –
La drépanocytose, la plus fréquente des maladies génétiques en France, a été reconnue comme une des priorités de la loi de santé publique de 2004, avec des objectifs de réduction de la mortalité et d’amélioration de la prise en charge et de la qualité de vie des personnes atteintes. Depuis 1980, parallèlement à l’augmentation de l’âge de décès et à la réduction de la mortalité des plus jeunes, on observe une augmentation régulière du nombre annuel de décès. Dans le cadre de la surveillance, une analyse des tendances de la mortalité liée à la drépanocytose a été réalisée.
Méthodes –
Il s’agit d’une analyse des certificats des décès liés à la drépanocytose enregistrés entre 1979 et 2010 en utilisant les codes spécifiques pour la drépanocytose de la version 9 et de la version 10 de la Classification internationale des maladies (CIM) en cause initiale et associée.
Résultats –
Sur la période 1979-2010, 953 décès liés à la drépanocytose ont été enregistrés en France. On observe un recul de l’âge médian des décès aussi bien en France métropolitaine (de 21,5 ans à 35,1 ans entre 1979-1994 et 1995-2010) que dans les départements d’outremer (DOM) (de 27,0 ans à 38,7 ans entre 1979-1994 et 1995-2010). Les taux de mortalité tout âge ont augmenté au cours de la période (de 0,30/106 en 1991-1995 à 0,35/106 en 2006-2010) en France métropolitaine et sont restés stables dans les DOM, après une période de baisse entre 1996 et 2000. Les taux ont diminué nettement chez les enfants de moins de 5 ans, passant de 1,68/106 à 0,89/106 entre 1991-1995 et 2006-2010. La drépanocytose est la cause initiale pour plus de la moitié des décès. Pour les décès restants, les causes correspondent aux complications et aux comorbidités les plus fréquentes de la drépanocytose. Finalement, l’âge médian au décès varie selon les causes initiales. Il est plus faible lorsque la cause initiale est une pathologie infectieuse, comparé à d’autres comorbidités.
Conclusion –
Ces résultats suggèrent que le dépistage précoce associé à une meilleure prise en charge de la maladie pendant l’enfance a eu un impact favorable sur la mortalité pédiatrique liée à la drépanocytose et sur l’âge au décès.
Abstract
Introduction –
Sickle cell anemia, which is the most frequent genetic diseases in France was acknowledged as a national health priority under the French Public Health Law of 2004, focusing mainly on the reduction of mortality and improving patient care and quality of life. Since 1980, together with the increase in the average age at death for adults and improved survival of young children and adolescents with sickle cell anemia, a regular increase of the annual number of death related to this condition has been observed. As part of surveillance, a trend analysis of death certificates was undertaken.
Methods –
An analysis of death certificates related to sickle cell anemia recorded between 1979 and 2010 was undertaken using the sickle cell anemia specific codes of version 9 and version 10 of the International Classification of Diseases (ICD) as initial and associated cause.
Results –
During the period 1979-2010, 953 deaths related to sickle cell anemia were recorded in France. Median age at death decreased in Metropolitan France (from 21.5 years to 35.1 years between 1979-1994 and 1995-2010) as well as in Overseas Departments (from 27.0 years in 1979-1994 and 38.7 in 1995-2010). Mortality rates for all ages increased regularly during the period under study (from 0.30/106 in 1991-1995 to 0.35/106 in 2006-2010 in Metropolitan France and remained stable in Overseas Departments, after a period of decrease between 1996 and 2000. The rates decreased significantly in children under five from 1.68/106 to 0.89/106 between 1991-1995 and 2006-2010. Sickle cell anemia is the initial diagnosis for more than 50% in death certificates and for the remaining, the causes are due to the most frequent complications and comorbidities of sickle cell anemia. Finally, the median age of death varies depending on the causes. Median age of deaths due to sickle cell anemia and associated to an infection is lower than deaths associated to other diseases.
Conclusion –
These results suggest that early screening associated to better case management during childhood has had a good impact on decreasing sickle cell mortality rates among children and adolescent and the doubling of average age of death.
Introduction
La drépanocytose, également appelée la maladie de l’hémoglobine S (HbS) ou encore anémie falciforme, est une anomalie génétique caractérisée par une déformation des hématies, qui prennent une forme de croissant ou de faucille (hématies falciformes) dans des conditions d’anoxie au lieu de rester rondes et souples. Les hématies déformées circulent mal dans les petits vaisseaux et l’insuffisante oxygénation des tissus est à l’origine de la douleur et des lésions caractéristiques de la maladie.
La drépanocytose est une maladie à transmission autosomique récessive par mutation d’un gène de la chaine ß de l’hémoglobine. Cette mutation induit la synthèse d’une hémoglobine anormale, l’HbS, principalement responsable de l’ensemble des manifestations cliniques vaso-occlusives et d’une hémolyse chronique avec anémie de degré variable. L’état homozygote S/S est la forme la plus fréquente de cette affection, mais d’autres allèles des gènes ß de l’Hb peuvent s’associer à l’HbS et induire la forme grave de la maladie : le syndrome drépanocytaire majeur (SDM). Les SDM regroupent trois formes génétiques principales : homozygoties S/S, hétérozygoties composites S/C et S/β° ou S/β+thalassémies. Les formes les plus sévères sont les homozygoties S/S ainsi que les S/β° thalassémies. Les individus hétérozygotes (AS) porteurs d’un trait drépanocytaire sont exceptionnellement symptomatiques.
L’affection débute généralement vers l’âge de 6 mois et se manifeste par des crises vasculo-occlusives qui occasionnent des douleurs de localisation et d’intensité variables, une anémie chronique et des épisodes infectieux sévères. La répétition de ces crises est responsable de complications invalidantes qui grèvent le pronostic fonctionnel et vital et sont à l’origine d’une mortalité élevée dans l’enfance 1. Par ailleurs, le risque d’infection est une conséquence sévère de la drépanocytose et l’une des principales causes de mortalité dans l’enfance avec les accidents vasculo-cérébraux (AVC). Parmi les adultes, les causes de mortalité sont diverses. Ce sont, principalement, les crises vaso-occlusives, le syndrome thoracique aigu, l’insuffisance rénale et les AVC. Les crises vaso-occlusives peuvent prendre plusieurs formes selon les organes atteints (foie, vésicule biliaire, rate).
La drépanocytose est une maladie surtout répandue en Afrique, en Inde, dans le Bassin méditerranéen et au Moyen-Orient 2. De ces régions, la drépanocytose s’est étendue à d’autres pays du fait des mouvements de population et des migrations. L’Afrique subsaharienne est particulièrement touchée : 1 nouveau-né sur 65 y est drépanocytaire 3.
En France, elle est la plus fréquente des maladies génétiques 4. Sa prévalence globale n’est pas estimée et son incidence est connue uniquement dans les départements d’outremer (DOM) où un dépistage néonatal systématique a été progressivement mis en place à partir de 1984. En France métropolitaine, le dépistage néonatal est ciblé sur les groupes d’origine géographique à risque depuis 1995. Environ 80% des cas dépistés à la naissance sont observés en Île-de-France et dans les DOM. D’après les données de l’Association française de dépistage et de prévention des handicaps de l’enfant (AFDPHE), de 2001 à 2012, l’incidence moyenne des SDM (1) à la naissance était de 1/4 962 naissances à La Réunion, 1/402 à la Martinique, 1/290 en Guadeloupe et 1/214 en Guyane. En Île-de-France, la drépanocytose est dépistée chez 1/1 014 des nouveau-nés testés 5,6. La fréquence du trait drépanocytaire était, de 2006 à 2012, de 1/19 dans les DOM, soit 5,4% des naissances, pour 1/46 en Île-de France, soit 2,2% des naissances.
La drépanocytose a été reconnue comme une des priorités de la loi de santé publique de 2004, avec des objectifs de réduction de la mortalité et d’amélioration de la prise en charge et de la qualité de vie des personnes atteintes 7. Au cours des dix dernières années, la prise en charge médicale s’est considérablement améliorée, avec la création en 2005 du centre de référence des syndromes drépanocytaires qui regroupe huit sites d’expertise dans des hôpitaux d’Île-de-France. Dans les DOM, un centre de référence de la drépanocytose a été labellisé en 2006 aux Antilles-Guyane et deux centres de compétence ont été labellisés en 2008, l’un en Guyane et l’autre à La Réunion-Mayotte. Des études sur la mortalité associée à la drépanocytose à partir des années 1980 en France montrent une amélioration progressive de la durée de vie des personnes atteintes, mesurée par le recul de l’âge médian au décès, et une diminution de la part des décès chez les enfants. Elles indiquent également une augmentation régulière du nombre annuel de décès 8,9. Dans le cadre de la surveillance épidémiologique de la drépanocytose, nous avons procédé à une actualisation de l’analyse de la mortalité dans le but de décrire l’évolution de ces tendances.
Matériel et méthodes
L’étude repose sur l’analyse des certificats de décès liés à la drépanocytose, enregistrés entre 1979 et 2012 par le Centre d’épidémiologie sur les causes médicales de décès (CépiDc) de l’Inserm. Dans cette étude, un décès lié à la drépanocytose a été défini par la présence d’un code de la classification internationale des maladies (CIM) spécifique de la drépanocytose, en cause initiale (la maladie ou le traumatisme qui a déclenché l’évolution morbide qui a conduit directement au décès) ou en cause associée au décès (état morbide ayant contribué au décès). Nous avons choisi de faire une « analyse en causes multiples » pour prendre en compte toutes les informations figurant sur le certificat de décès et avoir ainsi une vision globale de l’effet de cette anomalie sur la mortalité.
La sélection des certificats de décès a été réalisée en utilisant tous les codes spécifiques pour la drépanocytose de la version 9 (1977-1999) et de la version 10 (2000) de la CIM. Dans la CIM-9, la drépanocytose apparaissait sur deux codes basés sur le phénotype qui pouvaient être rapprochés l’un au génotype homozygote (forme manifeste de la maladie) et l’autre aux hétérozygotes AS (forme latente) (tableau 1). Des formes homozygotes ou des variantes sans crises pouvaient être éventuellement codées en forme latente. L’évolution de la CIM-9 vers la CIM-10 s’est effectuée sans continuité. Dans la CIM-10, utilisée depuis 2000, les affections à hématies falciformes sont distribuées sur cinq codes qui tiennent compte aussi bien du génotype que de la présentation clinique, avec un code spécifique pour le trait drépanocytaire (tableau 1). Cette analyse de la mortalité menée sur la période 1979-2010, couverte par les deux CIM successives, a inclus le code de la forme latente de la CIM-9 et, à partir de 2000, le code du trait drépanocytaire de la CIM-10 (D57.3) compte-tenu de son chevauchement avec la forme latente de la CIM-9.
 Agrandir l'image
Agrandir l'image
Le département ou pays de naissance est noté systématiquement dans les certificats de décès depuis 2000. Ceci a permis l’analyse du pays d’origine des personnes décédées, quels que soient leur nationalité et le lieu de décès.
Pour analyser l’évolution de la mortalité, les taux de mortalité (nombre de décès liés à la drépanocytose/population étudiée) ont été standardisés sur l’âge, en utilisant la population française du recensement de 1990 comme population de référence, comme c’est l’usage dans l’analyse des évolutions de mortalité. Ils sont présentés « tout âge » pour la France métropolitaine et pour les DOM. De 1979 à 1989, les estimations de population sont disponibles uniquement pour la France métropolitaine. Pour les DOM, ces estimations ne sont disponibles de manière exhaustive que depuis 1990. Pour cette raison, les taux de mortalité ont été estimés à partir de 1991.
Pour l’analyse des causes de décès, ont été prises en compte d’une part les causes initiales, qui représentent les causes principales des décès et, d’autre part, les causes associées qui ont contribué au décès. En raison de l’évolution du processus de codage des certificats de décès (passage d’un codage manuel à un codage automatique) et des modifications du mode d’enregistrement des causes associées à partir de 2000 avec le passage de la CIM-9 à la CIM-10 10, l’analyse des causes associées a été réalisée séparément pour deux périodes : 1979-1999 et 2000-2010.
Résultats
Distribution des décès enregistrés
Au total, sur l’ensemble de la période 1979-2010, 953 décès liés à la drépanocytose ont été enregistrés en France, dont 541 (56,8%) en cause initiale et 412 (43,2%) en cause associée. Parmi ces 953 décès, 30 (3,1%) sont associés aux formes les plus bénignes (28 formes latentes avec le code 282.5 de la CIM-9 et 2 traits drépanocytaires avec le code D57.3 de la CIM-10 (tous deux codés uniquement en diagnostic associé).
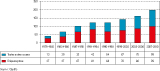
La répartition de ces décès par période est montrée en figure 1.
 Agrandir l'image
Agrandir l'image
Le nombre des décès enregistrés augmente régulièrement chaque année au cours de la période, passant de 40 en 1979-1982, soit 10 décès en moyenne par an, à 198 décès en 2007-2010 soit environ 49 décès par an (figure 1).
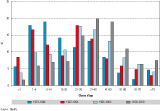
Par ailleurs, la répartition des décès par classe d’âge et par période (figure 2) montre une nette diminution de la part des décès des plus jeunes à partir du milieu des années 1990 et, au fil des années, un déplacement de l’âge de décès vers des classes d’âges plus élevées.
 Agrandir l'image
Agrandir l'image
L’âge au décès
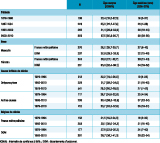
Au cours de la période d’étude, l’âge médian de décès lié à la drépanocytose est passé de 18 à 36 ans entre 1979-1986 et 2003-2010 (p<0,0001). Il varie selon que l’enregistrement de la drépanocytose est en cause initiale (27 ans) ou en cause associée (35 ans) (p<0,001). Il diffère aussi selon la zone géographique du décès : 31 ans en France métropolitaine contre 38 ans dans les DOM en 1995-2010 (p<0,001) (tableau 2).
 Agrandir l'image
Agrandir l'image
On constate que la proportion de sujets nés à l’étranger diffère chez les drépanocytaires décédés en France métropolitaine (49%) et ceux décédés dans les DOM (7%). Dans les DOM, cette proportion varie d’un département à l’autre (La Réunion : 0%, Martinique : 1,5%, Guadeloupe : 6,1%, Guyane : 25%). L’âge médian au décès diffère également dans ces départements (La Réunion : 33 ans, Martinique : 47 ans, Guadeloupe : 45 ans et Guyane : 18,5 ans).
Causes des décès liés à la drépanocytose
Parmi les 412 décès pour lesquels la drépanocytose est mentionnée comme cause associée, la répartition des causes initiales de décès montre une majorité d’affections de l’appareil circulatoire, suivies par des maladies infectieuses et des affections de l’appareil digestif.
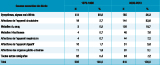
Les affections codées comme la cause initiale des décès (hors drépanocytose) correspondent aux complications et aux comorbidités de la drépanocytose les plus fréquentes (tableau 3). Parmi les affections de l’appareil circulatoire, ce sont les maladies cérébro-vasculaires, notamment l’accident vasculaire cérébral (AVC) hémorragique ou ischémique, qui constituent la cause la plus fréquente, suivie des cardiopathies non ischémiques. Parmi les causes infectieuses, les infections gastro-intestinales, les septicémies et les infections par le VIH sont les plus fréquentes. Parmi les affections de l’appareil digestif, ce sont les maladies du foie et les maladies intestinales non infectieuses les plus fréquentes.
 Agrandir l'image
Agrandir l'image
L’âge médian de décès est associé à certaines comorbidités de la drépanocytose : il est plus élevé lorsque la cause initiale est une affection de l’appareil circulatoire (36 ans) que lorsqu’il s’agit d’une maladie infectieuse (24 ans).
L’analyse de l’évolution des causes initiales de décès montre une diminution des maladies infectieuses au profit des maladies de l’appareil circulatoire et de l’appareil digestif (tableau 4). Cette diminution de la part des maladies infectieuses est également observée chez les 0-18 ans.
La part de la drépanocytose en tant que cause initiale de décès diminue au cours du temps, laissant supposer qu’il y a une meilleure identification des causes spécifiques de décès liées à cette maladie.
 Agrandir l'image
Agrandir l'image
Par ailleurs, l’analyse des causes associées du décès, lorsque la drépanocytose en est la cause initiale, montre l’évolution de la répartition des causes de décès codées dans les certificats entre les deux périodes correspondant à la CIM-9 et à la CIM-10 (tableau 5). Jusqu’à 1999, les causes associées sont majoritairement des symptômes et des signes mal définis (86,6%) alors qu’à partir de 2000, plusieurs catégories sont représentées. Il s’agit principalement de signes et symptômes mal définis (26,3%), d’affections de l’appareil circulatoire et de maladies du sang.
 Agrandir l'image
Agrandir l'image
Taux de mortalité
Les taux brut et les taux standardisés ont été calculés et sont identiques sur toute la période. Le taux de mortalité tout âge est de 0,35/106 sur la période 1991-2010 pour la France métropolitaine (tableau 6), et de 0,94/106 pour les DOM. En France métropolitaine, ces taux présentent une tendance à l’augmentation au cours de la période. Chez les moins de 5 ans, le taux standardisé de mortalité France entière pour 1991-2010 est de 1,16/106 et diminue au cours de la période étudiée.
 Agrandir l'image
Agrandir l'image
Le taux de mortalité tout âge en France métropolitaine a augmenté au cours de la période, avec une variation moyenne annuelle de +3,3%. Dans les DOM, on observe une diminution du taux avant 2000, puis une stabilisation jusqu’en 2010 (figure 3). La variation moyenne annuelle (1,8%) reflète cette diminution du taux avant 2000. Cette progression est mieux observée dans les taux lissés sur trois ans. Pour les enfants de moins de 5 ans, l’évolution des taux standardisés de mortalité présente, malgré une grande variabilité en nombre de décès chaque année, une baisse nette depuis le milieu de la décennie 1990, avec un taux de variation moyen annuel de -4,8%.
 Agrandir l'image
Agrandir l'image
Discussion
Cette étude présente l’évolution de la mortalité associée à la drépanocytose en France pour la période 1979-2010.
Les taux de mortalité « tout âge » ont augmenté pendant la période étudiée, alors que ces taux ont diminué pour les enfants de 0-5 ans tout au long de la même période. Cette amélioration de la survie des enfants drépanocytaires reflète l’impact de la mise œuvre du dépistage néonatal et des stratégies de prise en charge avec des traitements et mesures de prophylaxie préconisés par la Haute Autorité de santé (HAS) 11. Les statistiques récentes de l’évolution de la mortalité associée à la drépanocytose, établies selon différentes méthodes-analyses de certificats de décès, enquêtes transversales ou études de cohorte – en France 8,12,13, aux États-Unis 14,15, en Angleterre 16, au Brésil 17 et en Tanzanie 18, confirment une baisse de la mortalité des enfants en raison de l’adoption d’une stratégie adaptée. Nos résultats sont cohérents avec ces études, qui montrent que le pic de l’incidence des décès s’est déplacé vers les tranches d’âges plus élevés, probablement en raison de l’introduction du dépistage à la naissance, de la prévention et de la prise en charge des complications au cours des premières années de vie. On observe également le recul de l’âge des décès, âge qui a doublé entre 1979-1986 et 2003-2010, aussi bien en France métropolitaine que dans les DOM. L’âge au décès est plus élevé dans les DOM qu’en France métropolitaine et ceci pour les deux périodes étudiées : 1979-1994 et 1995-2010. Les données de ces certificats montrent que les décès liés à la drépanocytose en France métropolitaine surviennent dans des populations issues de migrations, ce qui n’est pas le cas dans les DOM.
L’amélioration du taux de survie des drépanocytaires a été rapportée dans des nombreuses populations, notamment lors d’études de cohorte menées aux États-Unis. Platt et coll. 19 ont étudié l’espérance de vie de patients drépanocytaires pendant les années 1980 et ont montré une évolution favorable à la survie des drépanocytaires dans le temps. Quinn et coll. 20 ont également montré une diminution globale de l’incidence de décès parmi une cohorte de nouveau-nés à Dallas entre 1983-1990 et 2000-2007. Yanni et coll. 21 ont montré une diminution des taux de mortalité parmi des enfants entre deux périodes : 1983-1986 et 1999-2002.
Dans notre étude, 71 décès (7,5%) sont attribués à une maladie infectieuse en diagnostic initial, dont 26 (8,9%) survenus chez les 0-18 ans. Cette proportion de décès pédiatriques par infection est plus faible que celles rapportées par le passé d’une part, en Île-de-France de 1985 à 1992 par Thomas et coll. 22, où une infection avait été la cause de 15 décès d’une série de 23 enfants, et d’autre part par Kremp et coll. 8 dans une analyse de certificats de décès parmi les 0-18 ans entre 1979 et 2004, où les épisodes infectieux représentaient 10,6% des causes initiales de décès. Ceci peut signifier une véritable diminution des épisodes infectieux avec le dépistage néonatal, la mise en place de mesures de prophylaxie et de prévention des infections chez les plus jeunes et un meilleur suivi des complications de la drépanocytose au cours des premières années de vie.
Finalement, les crises vaso-occlusives n’ont pas de code spécifique, tant dans la CIM-9 que dans la CIM-10, et ne peuvent pas de ce fait être identifiées spécifiquement dans les certificats de décès. Caractérisées cliniquement par des « épisodes de douleur », elles sont le principal motif de recours aux soins des patients drépanocytaires et l’une des causes prédominantes de décès chez les adultes drépanocytaires en France 12,23. Tous les patients drépanocytaires sont exposés à leur survenue brutale et imprévisible, susceptible d’engager le pronostic vital 24,25.
Le taux de mortalité pour les adultes résidant en France métropolitaine semble être en augmentation au cours de la période 1979-2010. L’évolution de la prise en charge a pu permettre l’amélioration du diagnostic de la maladie chez un certain nombre de patients, en particulier des adultes, et ainsi l’identification de décès qui n’auraient pas été auparavant rapportés à la drépanocytose. D’autres facteurs pourraient être également évoqués, par exemple l’arrivée en France de migrants originaires de régions à incidence élevée, comme peut le faire supposer la proportion importante de patients nés à l’étranger chez les drépanocytaires décédés en France métropolitaine.
Conclusion
La drépanocytose est une maladie génétique grave qui nécessite des soins en permanence. Cette analyse des données des certificats de décès confirme qu’on observe en France, comme cela a été montré aux États-Unis, une diminution du taux de mortalité liée à la drépanocytose parmi les enfants en bas âge, la diminution de la part des infections comme cause de décès et le recul de l’âge au décès. Ces constats sont encourageants. Ils suggèrent que le dépistage précoce associé à une meilleure prise en charge de la maladie pendant l’enfance a eu un impact sur les complications infectieuses de la drépanocytose et sur la mortalité dès le plus jeune âge.




