Middle East Respiratory Syndrome Coronavirus (MERS-CoV) : point épidémiologique international et national deux ans après l’identification de cet agent pathogène émergent
// Middle East Respiratory Syndrome Coronavirus (MERS-CoV): International and national epidemiological update two years after the first identification of this emerging pathogen
Résumé
Le Middle East Respiratory Syndrome coronavirus (MERS-CoV) a été identifié en septembre 2012. Les formes cliniques sont essentiellement des infections respiratoires de sévérité variable pouvant évoluer vers un tableau de détresse respiratoire aiguë, mais des formes asymptomatiques ont également été décrites. Le principal réservoir animal à l’origine de cette émergence chez l’homme est probablement représenté par les camélidés. L’existence d’une transmission croisée dromadaire-homme a été documentée.
En France, l’Institut de veille sanitaire assure une veille internationale sur cette émergence et a mis en place une surveillance nationale depuis octobre 2012.
Au 9 décembre 2014, 918 cas d’infection à MERS-CoV et 331 décès (létalité estimée : 36%) avaient été déclarés à l’Organisation mondiale de la santé. Les foyers épidémiques les plus importants décrits sont survenus dans des contextes nosocomiaux et familiaux. L’Arabie saoudite est le pays qui a notifié le plus grand nombre de cas avec un total de 819 cas d’infection à MERS-CoV. À ce jour, 24 cas ont été déclarés en dehors de la Péninsule arabique. En France, depuis octobre 2012, parmi les 861 signalements de cas suspects, 265 cas possibles ont été testés et, parmi eux, 2 cas d’infection à MERS-CoV ont été confirmés en mai 2013.
Abstract
The Middle East Respiratory Syndrome coronavirus (MERS-CoV) was first identified in September 2012. Clinical presentations of MERS-CoV infection range from asymptomatic to very severe pneumonia with acute respiratory distress syndrome. There is some scientific evidence that dromedary camel is a host species for MERS-CoV and that camels play an important role in the transmission to humans. The existence of cross transmission between dromedary camel and man has been documented.
In France, the French Institute for Public Health Surveillance is monitoring the international epidemiological situation and has implemented national surveillance since October 2012.
As of 9 December 2014, 918 confirmed cases have been reported to the World Health Organization including 331 deaths (case fatality rate: 36%). The most important outbreaks are linked to household or nosocomial clusters. Most of the cases occurred mainly in Saudi Arabia with 819 confirmed cases. To date, 24 cases have been notified outside the Middle East region. In France, 861 suspect cases have been notified, 265 possible cases were tested and 2 confirmed cases were diagnosed in May 2013.
Introduction
En avril 2012, en Jordanie, un patient de 25 ans, hospitalisé pour un syndrome de détresse respiratoire, décède après avoir probablement été à l’origine d’un foyer épidémique nosocomial (10 soignants et 2 de leurs contacts communautaires) 1,2. Les investigations conduites par les autorités sanitaires ne permettent pas d’identifier l’étiologie de cette pathologie. En septembre 2012, deux patients contractent, l’un au Royaume d’Arabie saoudite et l’autre au Qatar, une infection respiratoire sévère mortelle. Les prélèvements respiratoires de ces deux patients mettent en évidence la présence d’un nouveau coronavirus. Ce même virus sera retrouvé dans une analyse a posteriori des liquides biologiques du premier patient du foyer jordanien 3,4. Cet agent pathogène émergent a été dénommé par la suite Middle East Respiratory Syndrome Coronavirus (MERS-CoV) 5, la majorité des cas ayant été identifiés dans la Péninsule arabique. Les premiers cas de MERS-CoV ne présentaient aucun lien épidémiologique entre eux : la seule exposition à risque commune était de résider ou d’avoir voyagé dans des pays de la Péninsule arabique. La source de contagion et les modalités de transmission restent à l’heure actuelle mal connues.
Le virus et le Middle East Respiratory Syndrome
Les coronavirus sont des virus à ARN largement répandus dans le monde animal. Ils infectent principalement les chauve-souris, mais sont également retrouvés chez nombre d’autres animaux domestiques et sauvages 3. Seuls quatre coronavirus sont endémiques chez l’homme (229E, OC43, NL63 et NKU1), où ils sont responsables d’infections respiratoires bénignes. Le MERS-CoV est un bêta-coronavirus du groupe C. In vitro, il est capable d’infecter les cellules humaines et celles de nombreux animaux (singe, chauve-souris, dromadaire, chèvre) 6,7. Le coronavirus humain le plus proche phylogénétiquement est le coronavirus du syndrome respiratoire aigu sévère (SRAS-CoV) 5.
La période d’incubation est comprise entre 2 et 14 jours 8. La transmission interhumaine se fait essentiellement par voie respiratoire dès lors que la personne infectée est symptomatique. Le tableau clinique est celui d’une infection respiratoire aiguë de sévérité variable, allant d’une infection des voies respiratoires hautes à une pneumopathie interstitielle pouvant évoluer dans certains cas vers une détresse respiratoire aiguë ou une défaillance multi-viscérale 8,9. Les symptômes associés sont essentiellement fièvre, toux, dyspnée et myalgie ; des troubles digestifs (diarrhée, vomissements, douleurs abdominales) ont été décrits, en particulier chez les personnes immunodéprimées 8,10,11. Des formes asymptomatiques ont été décrites sans qu’on puisse en définir la proportion exacte en l’état des connaissances actuelles. Une estimation de cette proportion été réalisée chez 280 contacts familiaux de 26 cas confirmés. Cette étude a montré que, parmi les 12 personnes chez qui une infection secondaire a été diagnostiquée par PCR (polymerase chain reaction) ou sérologie, 11 (91,6%) étaient asymptomatiques 12. On ne peut cependant pas extrapoler cette proportion à l’ensemble de la population.
Chez l’homme, le virus est retrouvé au niveau des voies respiratoires et, à faibles concentrations, dans le sang, les urines et les selles 10,13. Le diagnostic d’infection à MERS-CoV est confirmé par l’identification du virus par RT-PCR (Real-time PCR) dans les prélèvements des voies respiratoires basses et/ou hautes. Une exposition au virus peut être mise en évidence par une sérologie positive (IgG et/ou IgM spécifiques), sans que ce test puisse avoir une valeur diagnostique formelle 14. En l’absence de thérapeutique spécifique et de vaccin, le traitement est purement symptomatique 15.
Le réservoir animal
Pour plusieurs cas communautaires d’infection à MERS-CoV survenus dans la Péninsule arabique, une exposition à des animaux domestiques de ferme a été décrite 16. Il semble donc probable que le MERS-CoV soit d’abord un agent pathogène animal, comme la grande majorité des bêta-coronavirus. Certaines études ont évalué l’exposition au virus des animaux domestiques et d’élevage communs dans la Péninsule arabique, tels que les ovins, caprins et camélidés. Elles ont mis en évidence : (a) une très forte prévalence des anticorps anti-MERS-CoV chez les camélidés (72 à 100% des animaux selon les populations étudiées) dans les zones du Moyen-Orient atteintes par l’épidémie humaine, en particulier Arabie saoudite, Oman, Jordanie et Émirats Arabes Unis (EAU) 17,18,19,20,21 ; (b) une séroprévalence importante dans de larges zones d’Afrique qui ne présentent pas de cas humains autochtones connus, telles que l’Egypte, l’Ethiopie, la Tunisie et le Nigeria 22,23. Une faible prévalence (14%) a été retrouvée chez des camélidés espagnols (îles Canaries), mais les anticorps anti-MERS-CoV n’ont pas été mis en évidence chez d’autres camélidés en Europe (Pays-Bas) 17 ni chez d’autres animaux d’élevage 17,18,20.
Le virus a été mis en évidence par RT-PCR dans les sécrétions respiratoires et, à moindre concentration, dans les selles, les urines et le lait des camélidés de la Péninsule arabique et d’Egypte, suggérant fortement leur rôle comme possible réservoir animal 21,24,25,26.
Les modes de transmission à l’homme
La transmission croisée animal-homme
L’étude rétrospective d’un foyer épidémique d’infections respiratoires humaines et animales survenu à Jeddah (Arabie saoudite) en novembre 2013 a permis de mettre en évidence un lien épidémiologique entre animal et homme. Le cas index de ce foyer serait en effet un éleveur de dromadaires, devenu symptomatique après avoir eu des contacts très rapprochés avec plusieurs de ses animaux qui présentaient des symptômes respiratoires. La comparaison du génome viral retrouvé chez ce patient et chez ses dromadaires a démontré que la séquence génétique était identique 27. Des échantillons d’air prélevés dans l’étable de ces animaux ont montré la présence d’ARN viral, ce qui pourrait être en faveur d’une transmission par voie aérienne entre l’animal et l’homme 28. La transmission possible du virus par consommation de viande et de lait cru 29 de dromadaire a été évoquée mais n’a pas été démontrée.
La transmission interhumaine
En Arabie saoudite, une étude prospective a décrit la totalité des cas possibles de MERS-CoV (patients hospitalisés pour infection sévère des voies respiratoires basses) recensés entre octobre 2012 et septembre 2013. Cette étude a en outre identifié les contacts des cas confirmés sur la même période. Au total, 5 065 individus (dont 2 800 cas finalement exclus, 108 cas confirmés et 2 157 contacts des cas confirmés) ont été soumis à une RT-PCR et à un questionnaire 30. Ce travail a mis en évidence trois types de transmission :
- une transmission intrafamiliale, avec un taux de transmission à 3,6% dans cet échantillon. Ce taux est comparable à celui d’une autre étude (4,3%), qui a évalué cette forme de transmission sur un échantillon de 280 contacts testés par RT-PCR et sérologie 12 ;
- une transmission hospitalière, avec un taux de transmission estimé à 1,12%. Depuis le début de cette épidémie, de nombreux foyers hospitaliers ont été décrits 2,11. La survenue de ces foyers nosocomiaux était probablement liée à l’absence de respect des mesures barrière, puisqu’aucune mutation du virus augmentant sa virulence et son potentiel de transmission n’a été mise en évidence 31,32. Cette transmission nosocomiale a également été documentée en France 33 ;
- une transmission sporadique communautaire dont il est difficile d’apprécier le taux du fait de nombreuses formes asymptomatiques.
La transmission interhumaine du MERS-CoV s’est effectuée le plus souvent dans un contexte de contacts prolongés entre le patient index et les cas secondaires, et elle apparaît limitée. Les premières estimations du taux de reproduction (R0) du virus variaient de 0,6 (IC95% : [0,42-0,8]) à 0,69 [0,50-0,92] 34. Les données d’un autre travail de modélisation plus récent estiment que le R0 serait de 0,5 [0,30-0,77], suggérant ainsi le faible potentiel épidémique du virus 35.
Une étude de séroprévalence conduite sur les 226 travailleurs d’un abattoir de bovins, ovins et camélidés en Arabie saoudite a montré que seules 2 personnes (0,8%) étaient porteuses d’anticorps anti-MERS-CoV, suggérant une très faible exposition de cette population au virus 36.
Les analyses phylogénétiques ne semblent pas montrer une transmission interhumaine continue et l’hypothèse de la présence simultanée de plusieurs souches dans la même aire géographique a été récemment étudiée. La circulation des hommes et des animaux infectés serait à l’origine de plusieurs foyers indépendants 13,37.
La surveillance épidémiologique
La surveillance épidémiologique des infections à MERS-CoV est réalisée par les autorités sanitaires nationales de chaque pays et est centralisée par l’Organisation mondiale de la santé (OMS). En conformité avec le Règlement sanitaire international (RSI), tous les cas confirmés d’infection à MERS-CoV doivent être déclarés à l’OMS 38. La description individuelle de chaque cas est rapportée soit par les communications RSI de l’OMS 16, soit par le ministère de la Santé du Royaume d’Arabie saoudite 39, pays qui déclare le plus de cas.
En France, la surveillance a été mise en place en octobre 2012 et est coordonnée par l’Institut de veille sanitaire (InVS). L’InVS réalise également une surveillance épidémiologique internationale, sur la base des publications de l’OMS et du ministère de la Santé d’Arabie saoudite.
Évolution de l’épidémie au plan international
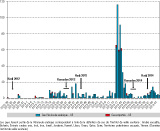
Au 9 décembre 2014, l’OMS rapportait 918 cas d’infection à MERS-CoV confirmés biologiquement, dont au moins 331 décès (létalité observée de 36 %) 40. Les cas sont répertoriés selon la date de notification. On observe les deux principaux pics épidémiques en 2014, le plus important entre mi-avril et mi-juin (semaines 16 à 23) et un second entre octobre et novembre (semaines 42 à 45) (figure 1).
 Agrandir l'image
Agrandir l'image
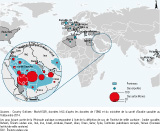
La plupart de ces cas ont été identifiés dans la Péninsule arabique, notamment en Arabie saoudite qui a rapporté à elle seule 819 cas, soit 89,2% des cas notifiés à l’OMS (figure 2).
L’épidémie semble présenter un profil saisonnier, avec une majorité de cas recensés entre les mois de mars et mai (en dehors du cluster nosocomial de l'automne 2014). L’hypothèse avancée est que le début de la période de transmission pourrait correspondre à la saison de mise bas des dromadaires. L’intensification de la transmission virale entre les générations de camélidés (jeunes dromadaires non immunisés) entrainerait un risque de transmission croisée plus élevé 41.
L’évolution du nombre de cas d’infection à MERS-CoV rapportés par les autorités nationales et internationales doit être interprétée en tenant compte des aspects suivants :
- l’existence d’une sensibilisation internationale pour la détection des cas sporadiques. Le prélèvement systématique des contacts pauci/asymptomatiques des cas avérés pourrait avoir entraîné une augmentation du nombre de cas signalés indépendamment de tout évènement épidémique. En outre, la présence antérieure de cas sporadiques ne peut pas toujours être exclue, d’autant plus que le MERS-CoV ne se manifeste pas toujours par des formes cliniquement sévères ;
- de la diversité des pratiques de cette détection selon les pays. En effet, par exemple, en Arabie saoudite tous les patients admis en unité de soins intensifs avec un tableau de détresse respiratoire sont systématiquement testés pour la recherche de virus MERS-CoV depuis octobre 2012 30. Dans d'autres pays du Moyen-Orient, les pratiques épidémiologiques pourraient être différentes ;
- l’existence de foyers épidémiques, notamment hospitaliers, de taille importante comme en Arabie saoudite, qui a contribué à une forte augmentation des notifications des cas, en particulier entre avril et mai 2013, entre mars et mai 2014 et entre octobre et novembre 2014 8,32.
Par ailleurs, la Péninsule arabique est le lieu de grands pèlerinages musulmans (l’Umrah - tout au long de l’année et surtout pendant le Ramadan - et le Hadj). Les pèlerinages du Hadj ont lieu pendant une période précise de l’année, durant laquelle plusieurs millions de pèlerins de tous les pays se rassemblent, en particulier à Médine et à La Mecque 42. Le risque d’exportation de la maladie peut donc s’accroitre lors du retour des pèlerins dans leurs pays d’origine. Cependant, à ce jour, l’épidémie de MERS-CoV est restée principalement localisée dans la région de la Péninsule arabique. L’Arabie saoudite, les EAU et la Jordanie sont les trois pays rapportant la majorité des cas ; le nombre de cas exportés (n=24) représente une proportion faible (2,6 %) du nombre de cas déclarés par l’OMS. Par ailleurs, la transmission autochtone secondaire, à partir de cas exportés, est restée très limitée, et a été documentée pour 1 cas en France 33, 2 cas en Tunisie 43 et 2 cas au Royaume-Uni 44 (figure 2).
La surveillance en France
En France, le dispositif de surveillance des infections respiratoires à MERS-CoV est coordonné par l’InVS depuis octobre 2012. Ce dispositif repose sur le signalement des cas suspects effectué par les cliniciens aux Agences régionales de santé (ARS) et sur leur classification en cas possible ou cas exclu par l’InVS, selon une définition de cas adaptée à l’évolution de la situation et des connaissances (1). La gestion de ces signalements est opérationnelle 7/7j et 24/24h. Chaque signalement fait l’objet d’une saisie anonyme des informations épidémiologiques, cliniques et microbiologiques sur une application informatique dédiée aux infections respiratoires.
Tout cas considéré possible d’infection à MERS-CoV donne lieu à des prélèvements qui sont analysés par l’un des laboratoires régionaux habilités à réaliser le diagnostic. Ces laboratoires ont validé les techniques de diagnostic en lien avec le Centre national de référence des virus influenzae, en charge de l’expertise microbiologique et qui, le cas échéant, confirme les résultats. Si un cas d’infection à MERS-CoV est confirmé, des investigations sont réalisées pour identifier et prévenir d’éventuels autres cas (sujets co-exposés ou en contact avec le cas). Ces investigations sont effectuées au moyen de questionnaires qui ont été élaborés en collaboration avec les partenaires de la surveillance. Ces questionnaires, destinés aux professionnels de santé, sont disponibles sur le site Internet de l’InVS (1).
Au 17 novembre 2014, le nombre total de signalements reçus depuis octobre 2012 était de 861 cas suspects, dont 265 (31%) répondaient à la définition de cas possible justifiant l’envoi d’un prélèvement aux laboratoires habilités (figure 3). Parmi eux, 2 cas confirmés d’infection à MERS-CoV ont été diagnostiqués en mai 2013 33,45. L’Île-de-France est la région recensant le plus de signalements (40% de l’ensemble des signalements).
 Agrandir l'image
Agrandir l'image
Depuis janvier 2014, sur les 351 cas suspects signalés, 122 étaient des cas possibles. Le nombre de signalements a connu, comme en 2013, un pic en octobre avec 159 signalements correspondant au retour des pèlerins du Hadj. En dehors de cette période et du mois de mai, au cours duquel 55 cas suspects avaient été signalés à l’InVS, le nombre mensuel de signalements reçus à l’InVS varie entre 4 et 29.
Les procédures relatives à la gestion et à la prévention des infections à MERS-CoV ont fait l’objet de deux avis du Haut Conseil de la santé publique, le premier le 28 juin 2013, actualisé le 30 octobre 2013 46.
Conclusions
Plus de deux ans après la découverte du premier cas humain d’infection à MERS-CoV, le bilan mondial en décembre 2014 fait état de 918 cas confirmés et d’une létalité proche de 36% chez les cas détectés. L’épicentre de l’infection reste localisé dans la Péninsule arabique, essentiellement en Arabie saoudite. Peu de cas ont été notifiés hors de cette région et tous (à l’exception des 5 cas sus-cités) avaient séjourné dans la Péninsule arabique dans les jours précédant l’infection. Un réservoir animal constitué, en particulier, des camélidés est fortement suspecté d’être à l’origine de la contamination humaine. La transmission interhumaine a été mise en évidence mais apparaît limitée, nécessitant des contacts proches et prolongés. La vigilance reste cependant de mise, et la surveillance des infections à l’échelle mondiale se poursuit car une modification de la situation épidémiologique ne peut être exclue en cas, par exemple, de mutation virale.
Remerciements
À tous les partenaires qui contribuent à la surveillance du MERS-CoV au niveau national et international : les cliniciens et biologistes des services hospitaliers, le Centre national de référence des virus Influenzae, l’Organisation mondiale de la santé, le ministère de la Santé d’Arabie saoudite, et à nos collègues des Cellules de l’Institut de veille sanitaire en régions (Cires), ainsi que toute l’équipe SIG du Département santé environnement de l’InVS.